Tempo di lettura stimato: 47 minuti
Creato: 16/09/2016 – Aggiornato: 06/05/2021
Questa è una traduzione non ufficiale di un articolo che è apparso in International Journal of Food Sciences and Nutrition una pubblicazione di Taylor & Francis online che non ha approvato questa traduzione
Studio clinico di dieta chetogenica a bassissimo contenuto calorico (dieta Oloproteica) seguita da una dieta Mediterranea ipocalorica, per il trattamento dell’obesità.
Giuseppe Castaldo(1), Luigi Monaco(2), Laura Castaldo, Giovanna Galdo(1) e Emanuele Cereda(3)
(1) Clinical Nutrition Unit, A.O.R.N. ‘‘San Giuseppe Moscati’’, Contrada Amoretta, Avellino, Italia;
(2) Ultrasonography Unit, A.O.R.N. ‘‘San Giuseppe Moscati’’, Contrada Amoretta, Avellino, Italia;
(3) Nutrition and Dietetics Service, Fondazione IRCCS Policlinico San Matteo, Viale Golgi, Pavia, Italia
RIASSUNTO
L’impatto di un programma dietetico riabilitativo che consista in diverse fasi di intervento dietoterapico è stato scarsamente studiato. In uno studio, 73 pazienti obesi sono stati sottoposti ad un programma di perdita di peso a due fasi: 3 settimane di dieta chetogenica a bassissimo contenuto calorico (<500 kcal al giorno; Dieta Oloproteica) seguite da 6 settimane di Dieta Mediterranea ipocalorica (ipo-MD) a basso indice glicemico (25-30 kcal al giorno, per kg di peso corporeo). Entrambe le fasi hanno ridotto il grasso viscerale, migliorato i livelli di enzimi epatici e GH, la pressione sanguigna ed il metabolismo glucidico e lipidico. Tuttavia la dieta ipo-MD ha portato ad un ri-aumento di lipidi nel sangue e dei parametri di tolleranza al glucosio. Le variazioni di adiposità viscerale e delle variabili legate al controllo glicemico sono state più consistenti nei pazienti con sindrome metabolica. Tuttavia in questi pazienti la dieta ipo-MD non ha comportato un ri-aumento dei parametri relativi al metabolismo glucidico. Un programma dietetico che consiste in un regime chetogenico seguito da dieta mediterranea equilibrata sembra essere fattibile ed efficace nel ridurre il rischio cardiovascolare, in particolare in pazienti con sindrome metabolica.
Introduzione

L’obesità, dato il suo importante contributo nella patogenesi di diverse malattie croniche, è un serio problema di salute pubblica in tutto il mondo (Skidmore & Yarnell 2004; Kosti & Panagiotakos 2006; Prentice 2006; ISTAT 2015). La gestione dell’obesità e delle complicanze ad essa associate è possibile ed efficace, ma comporta alti costi (Wang et al. 2011). D’altra parte molti studi hanno dimostrato che la perdita di peso (WL) indotta dalla dieta, potrebbe essere molto efficace per migliorare o addirittura risolvere molte comorbidità associate (Franz et al. 2007; Jensen et al. 2014): In relazione a questo, sono disponibili differenti strategie dietetiche e, a breve termine, tutte sembrano portare ad una significativa perdita di peso (Dansinger et al. 2005; Tsai & Wadden 2005; Franz et al. 2007; Gardner et al. 2007).
Tuttavia alcune di queste sono da preferirsi ad altre, a causa di benefici più consistenti sia a breve che lungo termine (Bravata et al. 2003; Wycherley et al. 2012; Paoli et al. 2013a). Le diete a bassissimo contenuto calorico (VLCDs), fornendo una quantità adeguata di proteine e micronutrienti, sembrano provocare una più consistente perdita di peso a breve termine e miglioramenti del profilo metabolico (principalmente del controllo glicemico e dell’insulino-resistenza), migliore composizione corporea dovuta al risparmio di proteine muscolari così come un maggiore mantenimento della perdita di peso corporeo a lungo termine (Bravata et al. 2003; Wycherley et al. 2012; Paoli et al. 2013a). Negli ultimi decenni, si è molto evoluto l’interesse nei confronti delle diete finalizzate al calo ponderale, e l’attenzione è stata focalizzata molto di più sulla loro composizione, in particolare sul contenuto dei carboidrati. Tra le strategie dietetiche, le diete a basso contenuto di carboidrati e chetogenica, hanno attratto diversi ricercatori. Gli effetti positivi della dieta chetogenica vanno aldilà della promozione della perdita di peso e sostanzialmente si basano sul positivo impatto sul metabolismo, in particolare sulla omeostasi glucidica (Hussain et al. 2012; Schugar & Crawford 2012; Wycherley et al. 2012; Paoli et al. 2013a).
Tuttavia, il mantenimento a lungo termine della perdita di peso in pazienti obesi è spesso difficile e non è infrequente assistere a fallimenti terapeutici ed al recupero del peso dopo pochi mesi dall’intervento. In particolare, l’adesione alla diete ipocaloriche-chetogeniche, potrebbe essere anche molto più difficile, principalmente a causa dell’alta restrizione calorica, e dovrebbe essere limitata a poche settimane. Per questo, dopo aver beneficiato del loro positivo impatto metabolico, i pazienti hanno bisogno di attuare un programma di riabilitazione dietetica, che preveda la progressiva reintroduzione dei carboidrati di elevata qualità, ed il passaggio ad un modello alimentare di dieta Mediterranea. Sebbene l’efficacia a breve termine dei diversi interventi dietetici per la perdita di peso siano stati oggetto di studio in parecchi studi comparativi e non comparativi, gli effetti dell’adesione alle due differenti diete eseguite in sequenza, sono stati scarsamente studiati. Per quel che sono i limiti della nostra conoscenza, ci sono solo due studi che conducono alla fattibilità ed alla efficacia della dieta bifasica chetogenica e mediterranea in soggetti obesi (Paoli et al. 2013b; Leonetti et al. 2015). Inoltre, sebbene le diete a bassissimo contenuto calorico siano state associate ad un miglioramento della sensibilità delle cellule β pancreatiche (Wing et al. 1994; Lim et al. 2011; Malandrucco et al. 2012), è stato scarsamente studiato l’impatto dell’intervento dietetico bifasico in pazienti insulino-resistenti. Al giorno d’oggi c’è solamente uno studio condotto da Leonetti et al. (2015), in un piccolo gruppo di pazienti con diabete di tipo 2 – in lista per chirurgia bariatrica laparoscopica – che ha mostrato una significativa riduzione e ri-aumento di glucosio nel sangue dopo 10 giorni di dieta chetogenica seguita da una dieta a basso contenuto di carboidrati (Leonetti et al. 2015). Poiché i dati provenienti da studi clinici consentono la progettazione di appropriati studi randomizzati, lo scopo di questo studio è stato quello di valutare la fattibilità e l’efficacia dell’adesione ad una dieta Mediterranea ipocalorica, a basso indice glicemico quando questa segue una dieta chetogenica a contenuto calorico molto basso.
Metodi
Materie di studio e progettazione
Per lo studio sono stati valutati pazienti obesi ambulatoriali dell’UO di Dietologia e Nutrizione Clinica dell’AORN “San Giuseppe Moscati ” tra Dicembre 2014 e Maggio 2015. Tutti i pazienti sono stati considerati potenzialmente idonei, indipendentemente dalla storia di fallimenti multipli nei programmi di perdita di peso. Sono stati considerati i seguenti criteri di esclusione: età ≥ 70 anni, diabete mellito di tipo 1 e 2, disturbi psichiatrici, neoplasie precedenti (<1 anno dall’ultima chemioterapia o radioterapia) o attuali, malattie cardio-vascolari, storia recente di perdita di peso indotta dalla dieta o non intenzionale (entro i 6 mesi precedenti), insufficienza cardiaca da moderata a grave, aritmie, insufficienza renale (creatinina >1,5 mg/dl), epatiti in corso, cirrosi epatica, malattia gastrointestinale di ogni tipo, ipoalbuminemia moderata-severa (<3,0 g/dl), elettroliti sierici alterati, gotta, mancato consenso informato scritto.
Intervento
I pazienti sono stati sottoposti al programma di perdita di peso a due fasi: 3 settimane di dieta chetogenica a bassissimo contenuto calorico (Dieta Oloproteica [OD]Ò) seguite da 6 settimane di Dieta Mediterranea ipocalorica (ipo-MD) a basso indice glicemico.
Fase I (OD). La Dieta Oloproteica rappresenta una implementazione della PSMF (protein-sparing modified fast, digiuno modificato per il risparmio proteico) elaborata da Blackburn all’inizio degli anni 70 (Bistrian et al. 1976; Blackburn et al. 1975) e recentemente adattata da differenti gruppi di ricercatori italiani come terapia per il trattamento dell’obesità grave e complicata (Cappello et al. 2012; Castaldo et al. 2016, 2015a, 2015b; Sukkar et al. 2013). In questi recenti studi l’intervento è consistito nella somministrazione di una formula nutrizionale liquida tramite sondino nasogastrico. Questo approccio consente di ottenere una compliance ottimale al trattamento ed una consistente perdita di peso in breve tempo in pazienti ad alto rischio e con una storia di fallimenti multipli. Tuttavia, un regime dietetico chetogenico a bassissimo contenuto calorico, può essere raggiunto tramite l’uso di cibi normali. Di conseguenza, durante la fase di Dieta Oloproteica, ai pazienti è stato chiesto di seguire una dieta molto ipocalorica (<500 kcal/giorno) a base di proteine che fornisce circa 10-20 g di carboidrati e lipidi al giorno. Le fonti di questi macronutrienti sono le verdure, olio di oliva, ed alimenti ricchi di proteine. Il contenuto proteico giornaliero totale della Dieta Oloproteica è stato impostato a 1,4 g per chilogrammo di peso corporeo ideale, calcolato dalla formula di Lorentz (WHO 1995). Metà di questa assunzione di proteine è stata fornita attraverso la somministrazione di una formulazione liquida contenente una quota fissa (1:6.5) di aminoacidi essenziali (arginina, ornitina alfa-keto-glutarato, taurina, cisteina, triptofano, idrossiprolina e citrullina) e proteine di elevato valore biologico come quello del siero di latte (Ghamin® – Gefaldiet Service Srl, Italia). Questa fase viene completata dalla somministrazione giornaliera di sostanze alcalinizzanti (Olobasic® – Gefaldiet Service Srl, Italia); calcio carbonato, 1500 mg al giorno; magnesio carbonato, 850 mg al giorno; potassio bicarbonato, 500 mg al giorno; sodio bicarbonato, 1500 mg al giorno; potassio citrato, 500 mg al giorno), rimedi erboristici in genere prescritti per le loro proprietà diuretiche, antiossidanti, anti-infiammatorie ed epato-protettive (Olodren® – Gefaldiet Service srl, Italia); contenente equiseto, biancospino, cardo mariano, ortica, orthosiphon e fucoxantina; (vedi Tabella S1) (Ferenci et al. 1989; Abidov et al. 2010; Carneiro et al. 2014; Liu et al. 2014; Maeda 2015; Namazi et al. 2011; Namazi et al. 2012; Trimarco et al. 2012) ed un completo (100% RDA) supplemento multivitaminico e multiminerale. I pazienti sono stati autorizzati a bere liberamente acqua o bevande senza zucchero (non tè o caffè) durante il giorno, raccomandando un apporto minimo di 2 L/giorno. In pazienti con una storia di calcoli renali, la quantità è stata aumentata a 3 L. Per evitare ipoglicemia non intenzionale ed uno squilibrio elettrolitico, tutti i trattamenti con farmaci ipoglicemizzanti e diuretici sono stati sospesi prima di iniziare il trattamento. Farmaci anti-ipertensivi ed acido urico e farmaci ipolipemizzanti sono stati lasciati invariati.
Fase II ( ipo-MD). Durante la fase ipo-MD, ai pazienti è stata prescritta una dieta ipocalorica equilibrata, che fornisce 25-30 kcal / kg di peso corporeo ideale al giorno (54% dai carboidrati, il 18% di energia da proteine e il 28% dai grassi [saturi, <7%]). In particolare, sono stati consumati il più possibile alimenti integrali, a basso indice glicemico (www.gly-cemicindex.com). Ai pazienti è stato chiesto anche di aggiungere più verdure ai pasti e consumare non più di due porzioni di frutta al giorno, al fine di aumentare l’assunzione di fibre fino a 30-35 g al giorno, senza eccedere con l’assunzione di zuccheri semplici. Consigliate anche fonti di proteine vegetali. Infine, l’olio d’oliva è stata la principale fonte di grassi, mentre non è stata permessa l’assunzione di alcol. Inoltre, i pazienti hanno continuato ad assumere rimedi alle erbe, così come aminoacidi e proteine del siero di latte (solo a colazione; una bustina da 15 g) in vista del mantenimento della massa muscolare durante la perdita di peso (Devries e Phillips 2015).
Valutazioni
I dati sui seguenti parametri sono stati raccolti al giorno 0 e alla fine di entrambe le fasi DO ed MD (giorno 22 e giorno 64, rispettivamente), prima che fosse reintrodotto qualsiasi trattamento farmacologico.
Antropometria
Il peso corporeo e l’altezza sono stati misurati con una bilancia munita di statimetro telescopico verticale in acciaio, secondo procedure standard (WHO 1995). Le circonferenze di vita (WC) e fianchi (HC) sono state misurate utilizzando un metro di plastica nel punto intermedio tra la costola più bassa e la cresta iliaca ed intorno alla parte più grande delle natiche, rispettivamente. L’indice di massa corporea (BMI; peso [kg]/ altezza [m²]), e il rapporto vita / fianchi (WHR) sono stati calcolati di conseguenza (WHO 1995).
Ecografia addominale
Abbiamo valutato lo spessore del grasso aorto-mesenterico (AMFT), come misura del grasso viscerale, secondo una procedura precedentemente validata (Monaco et al. 2014). I pazienti sono stati anche sottoposti a screening per la presenza di epatopatia colestatica (colelitiasi palese o fango biliare).
Ematochimica e Biochimica
Dopo una notte di digiuno (8-12 h), campioni di sangue venoso sono stati prelevati per la valutazione dei seguenti parametri: glucosio, insulina, peptide-C, emoglobina glicosilata, ormone della crescita (GH), fattore di crescita insulino-simile 1 (IGF-1), urea (BUN), creatinina, acido urico, colesterolo totale, colesterolo HDL e LDL, trigliceridi, aspartato e alanina amino-transferasi (AST e ALT, rispettivamente), gamma glutamil-transferasi(ɤ-GT), ed elettroliti (sodio e potassio). L’insilino-resistenza è stata stimata mediante il calcolo dell’HOMA Index (HOMA-IR) (Matthews et al. 1985). E’ stato anche considerato il rapporto colesterolo HDL e trigliceridi (McLaughlin et al. 2003).
Pressione arteriosa
Dopo aver fatto sedere il paziente per almeno 5 minuti su una sedia, sono stati misurate le pressioni sistolica e diastolica (PAS e PAD, rispettivamente) utilizzando sfigmomanometri di dimensioni appropriate, con i piedi sul pavimento, ed il braccio appoggiato a livello del cuore. E’ stata anche registrata la frequenza cardiaca. La media di tre misurazioni, ottenuta ad intervalli di 2 minuti, è stata utilizzata per l’analisi (Chobanian et al. 2003).
Controlli su campione di urina
Durante la fase di OD ai pazienti è stato chiesto di monitorare giornalmente lo stato di chetosi mediante l’uso di stick urinari (Accu-Chek ketur-Test®, Roche Diagnostics, Indianapolis, IN).
Diagnosi di sindrome metabolica
I criteri proposti dal National Cholesterol Education Program Treatment Panel III sono stati utilizzati per definire la presenza di sindrome metabolica (NCEP-III 2001). Di conseguenza, i soggetti dovevano avere almeno 3 delle seguenti caratteristiche: (1) circonferenza vita >102 cm negli uomini e >88 cm nelle donne; (2) trigliceridi sierici ≥150 mg/dL e/o l’uso di farmaci ipolipemizzanti; (3) colesterolo HDL <40 mg/dL negli uomini e <50 mg/
Questa è una traduzione non ufficiale di un articolo che è apparso in International Journal of Food Sciences and Nutrition una pubblicazione di Taylor & Francis online che non ha approvato questa traduzione
Studio clinico di dieta chetogenica a bassissimo contenuto calorico (dieta Oloproteica) seguita da una dieta Mediterranea ipocalorica, per il trattamento dell’obesità.
Giuseppe Castaldo(1), Luigi Monaco(2), Laura Castaldo, Giovanna Galdo(1) e Emanuele Cereda(3)
(1) Clinical Nutrition Unit, A.O.R.N. ‘‘San Giuseppe Moscati’’, Contrada Amoretta, Avellino, Italia;
(2) Ultrasonography Unit, A.O.R.N. ‘‘San Giuseppe Moscati’’, Contrada Amoretta, Avellino, Italia;
(3) Nutrition and Dietetics Service, Fondazione IRCCS Policlinico San Matteo, Viale Golgi, Pavia, Italia
RIASSUNTO
L’impatto di un programma dietetico riabilitativo che consista in diverse fasi di intervento dietoterapico è stato scarsamente studiato. In uno studio, 73 pazienti obesi sono stati sottoposti ad un programma di perdita di peso a due fasi: 3 settimane di dieta chetogenica a bassissimo contenuto calorico (<500 kcal al giorno; Dieta Oloproteica) seguite da 6 settimane di Dieta Mediterranea ipocalorica (ipo-MD) a basso indice glicemico (25-30 kcal al giorno, per kg di peso corporeo). Entrambe le fasi hanno ridotto il grasso viscerale, migliorato i livelli di enzimi epatici e GH, la pressione sanguigna ed il metabolismo glucidico e lipidico. Tuttavia la dieta ipo-MD ha portato ad un ri-aumento di lipidi nel sangue e dei parametri di tolleranza al glucosio. Le variazioni di adiposità viscerale e delle variabili legate al controllo glicemico sono state più consistenti nei pazienti con sindrome metabolica. Tuttavia in questi pazienti la dieta ipo-MD non ha comportato un ri-aumento dei parametri relativi al metabolismo glucidico. Un programma dietetico che consiste in un regime chetogenico seguito da dieta mediterranea equilibrata sembra essere fattibile ed efficace nel ridurre il rischio cardiovascolare, in particolare in pazienti con sindrome metabolica.
Introduzione
L’obesità, dato il suo importante contributo nella patogenesi di diverse malattie croniche, è un serio problema di salute pubblica in tutto il mondo (Skidmore & Yarnell 2004; Kosti & Panagiotakos 2006; Prentice 2006; ISTAT 2015). La gestione dell’obesità e delle complicanze ad essa associate è possibile ed efficace, ma comporta alti costi (Wang et al. 2011). D’altra parte molti studi hanno dimostrato che la perdita di peso (WL) indotta dalla dieta, potrebbe essere molto efficace per migliorare o addirittura risolvere molte comorbidità associate (Franz et al. 2007; Jensen et al. 2014): In relazione a questo, sono disponibili differenti strategie dietetiche e, a breve termine, tutte sembrano portare ad una significativa perdita di peso (Dansinger et al. 2005; Tsai & Wadden 2005; Franz et al. 2007; Gardner et al. 2007). Tuttavia alcune di queste sono da preferirsi ad altre, a causa di benefici più consistenti sia a breve che lungo termine (Bravata et al. 2003; Wycherley et al. 2012; Paoli et al. 2013a). Le diete a bassissimo contenuto calorico (VLCDs), fornendo una quantità adeguata di proteine e micronutrienti, sembrano provocare una più consistente perdita di peso a breve termine e miglioramenti del profilo metabolico (principalmente del controllo glicemico e dell’insulino-resistenza), migliore composizione corporea dovuta al risparmio di proteine muscolari così come un maggiore mantenimento della perdita di peso corporeo a lungo termine (Bravata et al. 2003; Wycherley et al. 2012; Paoli et al. 2013a). Negli ultimi decenni, si è molto evoluto l’interesse nei confronti delle diete finalizzate al calo ponderale, e l’attenzione è stata focalizzata molto di più sulla loro composizione, in particolare sul contenuto dei carboidrati. Tra le strategie dietetiche, le diete a basso contenuto di carboidrati e chetogenica, hanno attratto diversi ricercatori. Gli effetti positivi della dieta chetogenica vanno aldilà della promozione della perdita di peso e sostanzialmente si basano sul positivo impatto sul metabolismo, in particolare sulla omeostasi glucidica (Hussain et al. 2012; Schugar & Crawford 2012; Wycherley et al. 2012; Paoli et al. 2013a).
Tuttavia, il mantenimento a lungo termine della perdita di peso in pazienti obesi è spesso difficile e non è infrequente assistere a fallimenti terapeutici ed al recupero del peso dopo pochi mesi dall’intervento. In particolare, l’adesione alla diete ipocaloriche-chetogeniche, potrebbe essere anche molto più difficile, principalmente a causa dell’alta restrizione calorica, e dovrebbe essere limitata a poche settimane. Per questo, dopo aver beneficiato del loro positivo impatto metabolico, i pazienti hanno bisogno di attuare un programma di riabilitazione dietetica, che preveda la progressiva reintroduzione dei carboidrati di elevata qualità, ed il passaggio ad un modello alimentare di dieta Mediterranea. Sebbene l’efficacia a breve termine dei diversi interventi dietetici per la perdita di peso siano stati oggetto di studio in parecchi studi comparativi e non comparativi, gli effetti dell’adesione alle due differenti diete eseguite in sequenza, sono stati scarsamente studiati. Per quel che sono i limiti della nostra conoscenza, ci sono solo due studi che conducono alla fattibilità ed alla efficacia della dieta bifasica chetogenica e mediterranea in soggetti obesi (Paoli et al. 2013b; Leonetti et al. 2015). Inoltre, sebbene le diete a bassissimo contenuto calorico siano state associate ad un miglioramento della sensibilità delle cellule β pancreatiche (Wing et al. 1994; Lim et al. 2011; Malandrucco et al. 2012), è stato scarsamente studiato l’impatto dell’intervento dietetico bifasico in pazienti insulino-resistenti. Al giorno d’oggi c’è solamente uno studio condotto da Leonetti et al. (2015), in un piccolo gruppo di pazienti con diabete di tipo 2 – in lista per chirurgia bariatrica laparoscopica – che ha mostrato una significativa riduzione e ri-aumento di glucosio nel sangue dopo 10 giorni di dieta chetogenica seguita da una dieta a basso contenuto di carboidrati (Leonetti et al. 2015). Poichè i dati provenienti da studi clinici consentono la progettazione di appropriati studi randomizzati, lo scopo di questo studio è stato quello di valutare la fattibilità e l’efficacia dell’adesione ad una dieta Mediterranea ipocalorica, a basso indice glicemico quando questa segue una dieta chetogenica a contenuto calorico molto basso.
Metodi
Materie di studio e progettazione
Per lo studio sono stati valutati pazienti obesi ambulatoriali dell’UO di Dietologia e Nutrizione Clinica dell’AORN “San Giuseppe Moscati ” tra Dicembre 2014 e Maggio 2015. Tutti i pazienti sono stati considerati potenzialmente idonei, indipendentemente dalla storia di fallimenti multipli nei programmi di perdita di peso. Sono stati considerati i seguenti criteri di esclusione: età ≥ 70 anni, diabete mellito di tipo 1 e 2, disturbi psichiatrici, neoplasie precedenti (<1 anno dall’ultima chemioterapia o radioterapia) o attuali, malattie cardio-vascolari, storia recente di perdita di peso indotta dalla dieta o non intenzionale (entro i 6 mesi precedenti), insufficienza cardiaca da moderata a grave, aritmie, insufficienza renale (creatinina >1,5 mg/dl), epatiti in corso, cirrosi epatica, malattia gastrointestinale di ogni tipo, ipoalbuminemia moderata-severa (<3,0 g/dl), elettroliti sierici alterati, gotta, mancato consenso informato scritto.
Intervento
I pazienti sono stati sottoposti al programma di perdita di peso a due fasi: 3 settimane di dieta chetogenica a bassissimo contenuto calorico (Dieta Oloproteica [OD]Ò) seguite da 6 settimane di Dieta Mediterranea ipocalorica (ipo-MD) a basso indice glicemico.
Fase I (OD). La Dieta Oloproteica rappresenta una implementazione della PSMF (protein-sparing modified fast, digiuno modificato per il risparmio proteico) elaborata da Blackburn all’inizio degli anni 70 (Bistrian et al. 1976; Blackburn et al. 1975) e recentemente adattata da differenti gruppi di ricercatori italiani come terapia per il trattamento dell’obesità grave e complicata (Cappello et al. 2012; Castaldo et al. 2016, 2015a, 2015b; Sukkar et al. 2013). In questi recenti studi l’intervento è consistito nella somministrazione di una formula nutrizionale liquida tramite sondino nasogastrico. Questo approccio consente di ottenere una compliance ottimale al trattamento ed una consistente perdita di peso in breve tempo in pazienti ad alto rischio e con una storia di fallimenti multipli. Tuttavia, un regime dietetico chetogenico a bassissimo contenuto calorico, può essere raggiunto tramite l’uso di cibi normali. Di conseguenza, durante la fase di Dieta Oloproteica, ai pazienti è stato chiesto di seguire una dieta molto ipocalorica (<500 kcal/giorno) a base di proteine che fornisce circa 10-20 g di carboidrati e lipidi al giorno. Le fonti di questi macronutrienti sono le verdure, olio di oliva, ed alimenti ricchi di proteine. Il contenuto proteico giornaliero totale della Dieta Oloproteica è stato impostato a 1,4 g per chilogrammo di peso corporeo ideale, calcolato dalla formula di Lorentz (WHO 1995). Metà di questa assunzione di proteine è stata fornita attraverso la somministrazione di una formulazione liquida contenente una quota fissa (1:6.5) di aminoacidi essenziali (arginina, ornitina alfa-keto-glutarato, taurina, cisteina, triptofano, idrossiprolina e citrullina) e proteine di elevato valore biologico come quello del siero di latte (Ghamin® – Gefaldiet Service srl, Italia). Questa fase viene completata dalla somministrazione giornaliera di sostanze alcalinizzanti (Olobasic® – Gefaldiet Service srl, Italia); calcio carbonato, 1500 mg al giorno; magnesio carbonato, 850 mg al giorno; potassio bicarbonato, 500 mg al giorno; sodio bicarbonato, 1500 mg al giorno; potassio citrato, 500 mg al giorno), rimedi erboristici in genere prescritti per le loro proprietà diuretiche, antiossidanti, anti-infiammatorie ed epato-protettive (Olodren® – Gefaldiet Service srl, Italia); contenente equiseto, biancospino, cardo mariano, ortica, orthosiphon e fucoxantina; (vedi Tabella S1) (Ferenci et al. 1989; Abidov et al. 2010; Carneiro et al. 2014; Liu et al. 2014; Maeda 2015; Namazi et al. 2011; Namazi et al. 2012; Trimarco et al. 2012) ed un completo (100% RDA) supplemento multivitaminico e multiminerale. I pazienti sono stati autorizzati a bere liberamente acqua o bevande senza zucchero (non tè o caffè) durante il giorno, raccomandando un apporto minimo di 2 L/giorno. In pazienti con una storia di calcoli renali, la quantità è stata aumentata a 3 L. Per evitare ipoglicemia non intenzionale ed uno squilibrio elettrolitico, tutti i trattamenti con farmaci ipoglicemizzanti e diuretici sono stati sospesi prima di iniziare il trattamento. Farmaci anti-ipertensivi ed acido urico e farmaci ipolipemizzanti sono stati lasciati invariati.
Fase II ( ipo-MD). Durante la fase ipo-MD, ai pazienti è stata prescritta una dieta ipocalorica equilibrata, che fornisce 25-30 kcal / kg di peso corporeo ideale al giorno (54% dai carboidrati, il 18% di energia da proteine e il 28% dai grassi [saturi, <7%]). In particolare, sono stati consumati il più possibile alimenti integrali, a basso indice glicemico (www.gly-cemicindex.com). Ai pazienti è stato chiesto anche di aggiungere più verdure ai pasti e consumare non più di due porzioni di frutta al giorno, al fine di aumentare l’assunzione di fibre fino a 30-35 g al giorno, senza eccedere con l’assunzione di zuccheri semplici. Consigliate anche fonti di proteine vegetali. Infine, l’olio d’oliva è stata la principale fonte di grassi, mentre non è stata permessa l’assunzione di alcol. Inoltre, i pazienti hanno continuato ad assumere rimedi alle erbe, così come aminoacidi e proteine del siero di latte (solo a colazione; una bustina da 15 g) in vista del mantenimento della massa muscolare durante la perdita di peso (Devries e Phillips 2015).
Valutazioni
I dati sui seguenti parametri sono stati raccolti al giorno 0 e alla fine di entrambe le fasi DO ed MD (giorno 22 e giorno 64, rispettivamente), prima che fosse reintrodotto qualsiasi trattamento farmacologico.
Antropometria
Il peso corporeo e l’altezza sono stati misurati con una bilancia munita di statimetro telescopico verticale in acciaio, secondo procedure standard (WHO 1995). Le circonferenze di vita (WC) e fianchi (HC) sono state misurate utilizzando un metro di plastica nel punto intermedio tra la costola più bassa e la cresta iliaca ed intorno alla parte più grande delle natiche, rispettivamente. L’indice di massa corporea (BMI; peso [kg]/ altezza [m²]), e il rapporto vita / fianchi (WHR) sono stati calcolati di conseguenza (WHO 1995).
Ecografia addominale
Abbiamo valutato lo spessore del grasso aorto-mesenterico (AMFT), come misura del grasso viscerale, secondo una procedura precedentemente validata (Monaco et al. 2014). I pazienti sono stati anche sottoposti a screening per la presenza di epatopatia colestatica (colelitiasi palese o fango biliare).
Ematochimica e Biochimica
Dopo una notte di digiuno (8-12 h), campioni di sangue venoso sono stati prelevati per la valutazione dei seguenti parametri: glucosio, insulina, peptide-C, emoglobina glicosilata, ormone della crescita (GH), fattore di crescita insulino-simile 1 (IGF-1), urea (BUN), creatinina, acido urico, colesterolo totale, colesterolo HDL e LDL, trigliceridi, aspartato e alanina amino-transferasi (AST e ALT, rispettivamente), gamma glutamil-transferasi(ɤ-GT), ed elettroliti (sodio e potassio). L’insulino-resistenza è stata stimata mediante il calcolo dell’HOMA Index (HOMA-IR) (Matthews et al. 1985). E’ stato anche considerato il rapporto colesterolo HDL e trigliceridi (McLaughlin et al. 2003).
Pressione arteriosa
Dopo aver fatto sedere il paziente per almeno 5 minuti su una sedia, sono stati misurate le pressioni sistolica e diastolica (PAS e PAD, rispettivamente) utilizzando sfigmomanometri di dimensioni appropriate, con i piedi sul pavimento, ed il braccio appoggiato a livello del cuore. E’ stata anche registrata la frequenza cardiaca. La media di tre misurazioni, ottenuta ad intervalli di 2 minuti, è stata utilizzata per l’analisi (Chobanian et al. 2003).
Controlli su campione di urina
Durante la fase di OD ai pazienti è stato chiesto di monitorare giornalmente lo stato di chetosi mediante l’uso di stick urinari (Accu-Chek ketur-Test®, Roche Diagnostics, Indianapolis, IN).
Diagnosi di sindrome metabolica
I criteri proposti dal National Cholesterol Education Program Treatment Panel III sono stati utilizzati per definire la presenza di sindrome metabolica (NCEP-III 2001). Di conseguenza, i soggetti dovevano avere almeno 3 delle seguenti caratteristiche: (1) circonferenza vita >102 cm negli uomini e >88 cm nelle donne; (2) trigliceridi sierici ≥150 mg/dL e/o l’uso di farmaci ipolipemizzanti; (3) colesterolo HDL <40 mg/dL negli uomini e <50 mg/dL nelle donne e/o l’uso di farmaci ipolipemizzanti; (4) pressione arteriosa ≥130 / 85 mmHg e/o l’uso di agenti ipertensivi; e (5) livello di glicemia a digiuno ≥110 mg/dL.
Variabili di interesse
I cambiamenti (aumento o riduzione a seconda dei casi) nei seguenti parametri di studio sono stati considerati come misure di efficacia del risultato: il peso corporeo, BMI, WC, HC, WHR, AMFT, acido urico, glucosio, insulina, HOMA-IR, peptide-C, emoglobina glicosilata, GH, IGF-1, colesterolo totale, HDL, LDL, trigliceridi, rapporto trigliceridi/HDL, AST, ALT, γ-GT, la pressione sanguigna (SBP e DBP) e la frequenza cardiaca. E’ stata anche registrata giornalmente la frequenza dei seguenti effetti indesiderati, tramite un questionario auto-compilato: astenia, mal di testa, vertigini, svenimenti, ipotensione ortostatica, bruciore di stomaco, nausee, vomito, palpitazioni, crampi muscolari, la fame e la costipazione.
Analisi statistica
A causa della mancanza di dati preliminari su un simile disegno di studio, il dimensionamento del campione è stato calcolato a priori secondo un potere statistico dell’80%, una dimensione dell’effetto di 0,5 (media entità; considerata come clinicamente significativa) (Cohen 1992) ed un errore di tipo I <1,7% (per tenere conto del numero di confronti). Pertanto, sono stati considerati nella popolazione almeno 72 pazienti da analizzare. Statistiche descrittive delle variabili di studio sono state riportate come media e deviazione standard o conteggi e percentuali a seconda dei casi. Il confronto tra i sessi al basale è stato eseguito utilizzando il test esatto di Fisher (variabili categoriche) e t-test di Student (variabili continue). Nell’analisi primaria, i cambiamenti nei parametri di studio durante ogni fase dell’intervento sono stati inizialmente confrontati nel tempo, utilizzando un modello misto per misure ripetute aggiustato per età, sesso, abitudine al fumo, la menopausa e la terapia farmacologica (ove opportuno).
Poi, abbiamo confrontato i cambiamenti tra pazienti con e senza sindrome metabolica (analisi secondaria). Di conseguenza, abbiamo aggiustato le variazioni dei parametri oggetto di studio per i valori basali con un’analisi di covarianza e li abbiamo confrontati con un modello misto per misure ripetute. E’ stata anche studiata l’interazione tra il tempo ed il gruppo (presenza di sindrome metabolica). Tutte le analisi statistiche sono state eseguite utilizzando il software statistico STATA versione 12.0 (Stata Corporation College Station, TX).
Comitato etico
Lo studio è stato eseguito in accordo con i principi della Dichiarazione di Helsinki ed il protocollo è stato approvato dal Comitato Etico della A.O.R.N. ” San Giuseppe Moscati ”. Da ogni paziente è stato ottenuto il consenso informato scritto.
Risultati
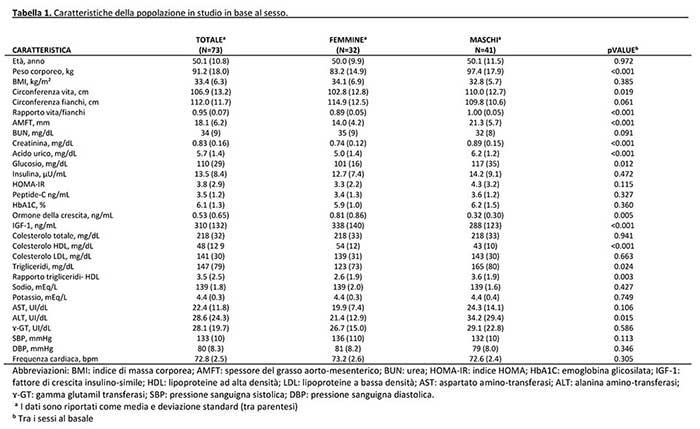
In totale sono stati reclutati 73 pazienti (BMI [media ± DS], 33,4 ± 6,3 kg/m² – raggio, 30.2-51.3 kg/m²) di 82 screenati. I principali motivi di esclusione sono stati: storia recente di perdita di peso indotta dalla dieta, n = 5; e il rifiuto del protocollo di studio, n = 3. Tra i 32 pazienti di sesso femminile reclutati, 17 erano in menopausa. Nessuna di loro assumeva contraccettivi orali o effettuava terapia ormonale sostitutiva. Lo stato di fumo attivo è stato segnalato da 16 pazienti. Le caratteristiche basali della popolazione in studio sono presentate nella tabella 1. In particolare, i pazienti di sesso maschile erano caratterizzati da maggiore adiposità addominale, glicemia, creatinina, acido urico, ALT, trigliceridi e rapporto trigliceridi-HDL e più bassi livelli di HDL. Di conseguenza, abbiamo osservato una leggera maggiore prevalenza di sindrome metabolica (58,5% contro il 50%; p-value= 0,487) ed una più frequente tendenza al diabete (24,4% contro 9,4%; p = 0,128). E’ stato anche osservato un più evidente compromissione dell’asse GH-IGF-1.
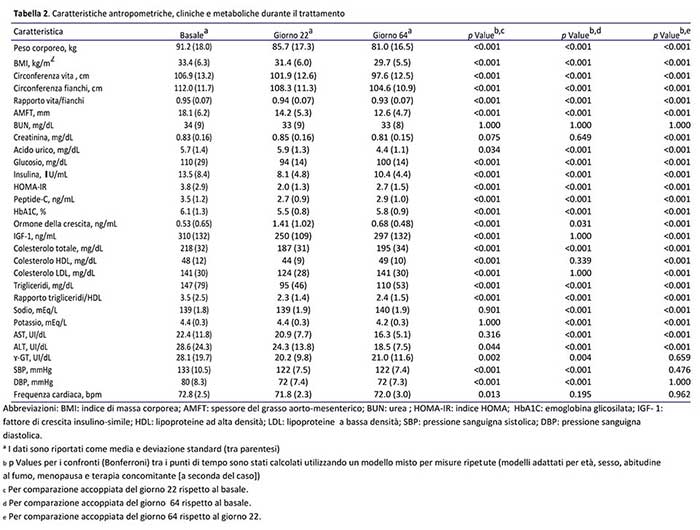
L’intervento è stato ben tollerato e non si sono verificati eventi avversi gravi. Durante tutto il periodo di trattamento, stipsi e lievi crampi muscolari sono stati gli effetti collaterali più frequentemente riportati (durante OD, 19,2% e 17,8%, rispettivamente). Tuttavia, le loro frequenze si sono significativamente ridotte durante la seconda fase dello studio (11,0% e 2,7%, rispettivamente). Anche la fame è stata segnalata (12,3% e 2,7% durante OD e ipo-MD, rispettivamente). Altri effetti indesiderati meno frequenti (<5%) riportati solo durante la prima fase di intervento, sono stati mal di testa e palpitazioni. Nel complesso, ”nessun effetto collaterale” durante la OD e ipo-MD è stato segnalato da 39 (53,4%) e 63 (86,3%) pazienti, rispettivamente. Come mostrato dai risultati, la perdita di peso corporeo, è stata elevata in entrambe le fasi di intervento: 7,5% e 10% del peso corporeo iniziale, rispettivamente nel 100% e 87,7% dei pazienti. I parametri biochimici hanno anche confermato la sostanziale sicurezza dell’intervento proposto. In particolare, nessuna alterazione (valore al di fuori del normale intervallo di laboratorio) si è verificata nei principali elettroliti sierici, enzimi epatici e parametri di funzionalità renale, anche se un leggero aumento di acido urico è stato osservato a livello di gruppo durante la fase OD (Tabella 2).
La fase di OD è stata associata ad un significativo miglioramento della adiposità viscerale, γ-GT, dei livelli di GH, della pressione sanguigna e della maggior parte dei parametri metabolici,in particolare di quelli relativi al metabolismo glucidico e lipidico; anche se è stato registrato un calo atteso del colesterolo HDL. Allo stesso modo, la OD è stata responsabile di una diminuzione significativa delll’IGF-1. E’ stato osservato un completo ritorno ai livelli basali di IGF-1 al termine della fase ipo-MD, durante la quale è stata anche osservata una riduzione del GH (a valori tuttavia superiori rispetto a quelli di inizio studio). La fase ipo-MD è stata anch’essa responsabile di un persistente effetto positivo sulla adiposità viscerale e sugli enzimi di funzionalità epatica, e di una riduzione consistente dei valori di uricemia. D’altra parte, anche se la progressiva reintroduzione di carboidrati ha portato al ripristino di HDL, questa fase di intervento si è associata ad un significativo rialzo dei parametri di metabolismo sia lipidico che glucidico, mentre la pressione sanguigna è rimasta sostanzialmente stabile.
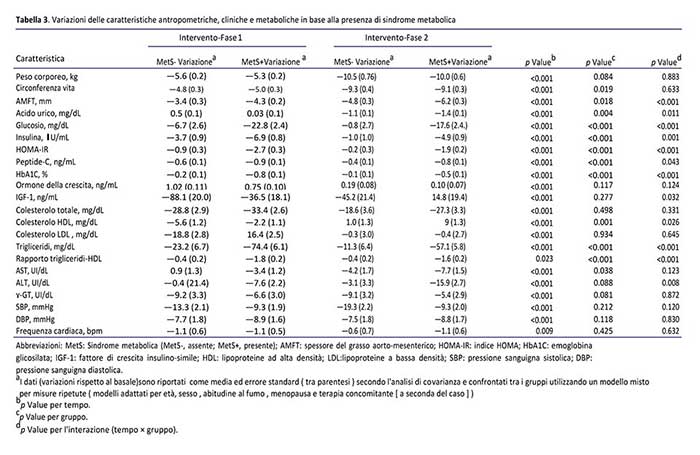
Nel complesso, la prevalenza di sindrome metabolica all’inizio dello studio era del 54,8%. Entrambi gli interventi hanno comportato una progressiva e significativa riduzione della sua frequenza (il rispetto al basale, p=0.017 e p=0.007 per la fase OD e ipo-MD, rispettivamente) e di quella dei relativi criteri diagnostici (Figura 1). In particolare, i cambiamenti più rilevanti sono stati osservati nella fase di OD, anche se una tendenza alla significatività è stata ancora osservata per la fase di ipo-MD. È interessante notare che, in termini di obiettivi secondari di efficacia (Tabella 3), è stato osservato che, indipendentemente da età, sesso, abitudine al fumo, menopausa e terapia farmacologica , la riduzione dell’adiposità viscerale ed il miglioramento delle variabili di controllo glicemico (glucosio, insulina, HOMA-IR, peptide-C, emoglobina glicosilata, trigliceridi, rapporto trigliceridi-HDL) e transaminasi sono stati ancora più marcati nei pazienti con sindrome metabolica. Rispetto a quelli senza, i pazienti con sindrome metabolica hanno mostrato un aumento meno evidente ed una maggiore diminuzione dell’acido urico rispettivamente durante le fasi OD ed ipo-MD. Inoltre, nei pazienti con sindrome metabolica è stata osservata una diminuzione meno evidente ed un più alto incremento di IGF-1 e HDL durante le fasi OD ed ipo-MD, rispettivamente.
Infine, per quanto riguarda il miglioramento del profilo cardiometabolico, si segnala anche che non è stato necessario ripristinare l’uso di agenti ipoglicemizzanti orali e la terapia diuretica. Allo stesso modo, la maggior parte dei pazienti (79,5%, 35 su 44 pazienti) ha richiesto una consistente riduzione del dosaggio (pillole/giorno) di una terapia anti-ipertensiva: basale, 0,86 ± 0,84; fine OD, 0,55 ± 0,66 (p <0.001 rispetto al basale); fine dello studio, 0,45 ± 0,58 (rispetto al basale, p <0.001; rispetto alla fase OD, p=0,016).
Discussione
In questo studio, abbiamo valutato gli effetti della adesione sequenziale a due diete diverse per di contenuto in macronutrienti in pazienti obesi. L’intervento di calo ponderale è consistito in una prima fase di 3 settimane di dieta chetogenica a bassissimo contenuto calorico, ed una successiva fase di 6 settimane di dieta mediterranea ipocalorica, a basso indice glicemico. Nonostante la diversa durata, le due fasi del programma dietetico hanno determinato una perdita di peso simile. Questo potrebbe essere ragionevolmente attribuito al diverso contenuto calorico delle diete (Dansinger et al 2005; Franz et al 2007; Gardner et al 2007; Wycherley et al 2012). Tuttavia, abbiamo osservato anche diversi effetti sulla distribuzione del grasso corporeo e parametri cardiometabolici nella popolazione totale e nei pazienti affetti da sindrome metabolica.
Senza dubbio, un esito positivo di questo studio è stata la compliance all’intervento, con circa il 90% dei pazienti che hanno perso almeno il 7,5% del peso corporeo iniziale e nessun ritiro dallo studio. Il programma dietetico si è dimostrato anche sicuro e ben accettato, e solo un numero limitato di pazienti ha riportato effetti collaterali, in particolare durante la fase di OD. Ciò è in accordo con studi precedenti che affrontano anche la sicurezza e la fattibilità di un digiuno modificato (Blackburn et al 1975; Cappello et al 2012; Sukkar et al 2013; Paoli et al 2013b; Leonetti et al 2015; Castaldo et al 2016, 2015a). Non sono stati segnalati disturbi emotivi, ma studi precedenti di perdita intensiva di peso hanno descritto una loro intensificazione, in particolare della depressione e dell’ansia (Stunkard & Rush 1974;. Halmi et al 1980).
Le diete fortemente ipocaloriche hanno inoltre sollevato ragionevoli preoccupazioni in passato, poiché regimi alimentari con un contenuto calorico inferiore al metabolismo basale potrebbero essere responsabili di malnutrizione, di minerali e micronutrienti a breve termine, e di tutti i nutrienti nel lungo termine (Blackburn et al. 1975; Gardner et al 2010). Inoltre, i regimi chetogenici sono noti essere potenzialmente in grado di causare squilibri elettrolitici ed un aumento dell’acido urico (Blackburn et al 1975; Atkinson 1986). Tuttavia, queste complicanze potrebbero essere evitate usando integratori appropriati e attraverso l’accorciamento della fase di digiuno modificato. Pertanto, un programma di riabilitazione alimentare sequenziale come quello qui proposto consente di ottenere benefici metabolici dei regimi dietetici chetogenici (Blackburn et al 1975; Lim et al 2011; Cappello et al. 2012;. Malandrucco et al 2012; Sukkar et al 2013; Paoli et al 2013b; Leonetti et al 2015; Castaldo et al 2016, 2015A), ma anche di limitare i potenziali effetti negativi associati al passaggio ad un modello alimentare sano ed equilibrato che considera i carboidrati come la principale fonte di calorie. La OD ha comportato una maggiore riduzione di adiposità viscerale rispetto alla ipo-MD, osservazione coerente con le evidenze disponibili sulle diete marcatamente ipocaloriche (Chaston & Dixon 2008). Inoltre, nonostante il significativo miglioramento di tutti i parametri cardiometabolici al termine dello studio, la reintroduzione di una quantità di circa 10 volte superiore di carboidrati di alta qualità, è stata responsabile di un rilevante ri-aumento della glicemia, dell’insulino-resistenza e dei lipidi sierici. Una maggiore assunzione di carboidrati è stata anche responsabile di una riduzione di GH. Tuttavia, abbiamo osservato un ripristino positivo di livelli di HDL, IGF-1 ed un mantenimento di migliori valori di pressione arteriosa. Tendenze analoghe sull’andamento della glicemia, dei lipidi e della pressione arteriosa sono stati recentemente osservati da Paoli et al. (2013b) e Leonetti et al. (2015) quando si applica una dieta chetogenica seguita da una dieta mediterranea o una dieta a basso contenuto calorico, che prevede l’aumento del contenuto in carboidrati. Queste osservazioni sottolineano chiaramente che in pazienti obesi, le complicanze metaboliche associate all’eccesso di peso non solo dipendono dalla distribuzione del grasso viscerale, ma anche dalla composizione della dieta e da come i macronutrienti sono metabolizzati anche in presenza di un bilancio energetico negativo.
Tuttavia, l’intero intervento ha comportato una progressiva riduzione della frequenza della sindrome metabolica e del numero dei suoi criteri in entrambe le fasi. In linea con questo, un risultato interessante sono stati i diversi effetti prodotti dai due regimi dietetici in base alla presenza di sindrome metabolica. Nei pazienti con sindrome metabolica, abbiamo osservato un maggiore miglioramento di tutti i parametri cardiometabolici e dell’ALT ed una riduzione del grasso viscerale durante entrambe le fasi. Questi cambiamenti sono stati ancora più costanti durante la fase OD. Inoltre, durante questa fase, a differenza di tutti gli altri partecipanti, abbiamo assistito ad un meno evidente aumento di acido urico e una più contenuta diminuzione dei livelli di HDL e IGF-1. Anche i risultati sostengono il beneficio metabolico di una dieta chetogenica, poichè l’ acido urico è considerato come una caratteristica aggiuntiva della sindrome metabolica (Billiet et al 2014) ed il trattamento con GH (con conseguente maggiore IGF-1) è stato associato alla riduzione del grasso viscerale (Berryman et al 2013).
I nostri risultati sono coerenti con le recenti osservazioni (Ala et al 1994; Lim et al 2011; Malandrucco et al 2012) che i benefici metabolici a breve termine della perdita di peso in pazienti con insulino-resistenza sono principalmente correlati alla restrizione calorica, piuttosto che ad un miglioramento della sensibilità periferica all’insulina. Di conseguenza, tutte le diete finalizzate al calo ponderale, indipendentemente dalla loro composizione, potrebbero essere efficaci nel ridurre il rischio cardiovascolare sia nel breve che nel lungo periodo (Douyon et al 2002; Dansinger et al 2005; Gardner et al 2007; Wycherley et al 2012; Kashyap et al 2013). Tuttavia, i miglioramenti più consistenti delle complicanze legate all’obesità nei pazienti con sindrome metabolica, suggeriscono che anche l’entità del deficit calorico e come questo è realizzato, può giocare un ruolo attivo. Un breve ciclo iniziale di dieta chetogenica nei pazienti insulino-resistenti esercita un effetto positivo sull’asse GH-IGF-1, inducendo la lipolisi nel tessuto adiposo viscerale, senza compromettere la sensibilità all’insulina (Douyon et al 2002; Schugar & Crawford 2012; Kashyap et al 2013). D’altro canto, studi di chirurgia bariatrica suggeriscono che anche l’ interruzione di assorbimento dei carboidrati svolge un ruolo nel ripristino della funzione delle cellule β-pancreatiche (Kashyap et al. 2013). Di conseguenza, un breve periodo di dieta chetogenica, a bassissimo contenuto calorico, deve essere preferito come strategia di prima linea, almeno nei pazienti insulino-resistenti. Poi, una riabilitazione alimentare ad una dieta equilibrata, potrebbe e dovrebbe essere considerata per evitare un dannoso effetto ”yo-yo” (Cereda et al. 2011). La riabilitazione può inoltre trarre vantaggio dalla transitoria ipofagia post-dieta indotta da chetosi (Honor et al 2009; Gibson et al 2015). Senza dubbio, la necessità di mantenimento a lungo termine della perdita di peso è una priorità e le diete fortemente ipocaloriche sono state valutate come responsabili di una maggiore perdita di peso iniziale e, nonostante un più rapido riguadagno di peso, di un risultato leggermente migliore a lungo termine (Franz et al 2007;. Hemmingsson et al., 2012).
Devono essere riconosciuti alcuni limiti del nostro studio. In primo luogo, non fornisce una risposta alla domanda ancora aperta di come raggiungere un mantenimento della perdita di peso a lungo termine, anche se gli interventi comportamentali fondati su dieta ed attività fisica probabilmente porteranno a un migliore risultato (Dombrowski et al. 2014). In secondo luogo, si potrebbe sostenere che l’uso di rimedi fito-terapici ha influenzato i risultati. Tuttavia, anche se sulla base dei risultati preliminari di alcuni studi clinici randomizzati (Lirussi et al 2002;. Asgary et al 2004;. Abidov et al 2010;. Cicero et al 2012;. Kianbakht et al 2013) un contributo non può essere pienamente escluso, come sopra riportato, i cambiamenti di parametri di efficacia erano coerenti con precedenti risultati sia in termini di direzione che di entità. Tuttavia, i rimedi sono stati usati continuamente durante entrambe le due fasi dello studio. Di conseguenza, un effetto di confondimento sull’impatto indipendente degli interventi dietetici era improbabile ma merita ulteriori indagini.
In terzo luogo, abbiamo condotto uno studio osservazionale prospettico senza gruppo di controllo. Uno studio di fattibilità è un passo importante per la progettazione di nuove strategie terapeutiche, ma è necessario uno studio randomizzato per sostenere i risultati attuali. D’altra parte, in questa prospettiva, il nostro studio rappresenta una preziosa verifica teorica e ha offerto un importante suggerimento su quale strategia di perdita di peso dovrebbe essere considerata in pazienti con sindrome metabolica.
In conclusione, un programma di riabilitazione alimentare costituito da un regime chetogenico fortemente ipocalorico seguito da una dieta mediterranea bilanciata sembra essere un programma fattibile, sicuro ed efficace nel ridurre il rischio cardiovascolare nei pazienti obesi, in particolare in coloro che sono caratterizzati da un’adiposità viscerale e da sindrome metabolica. Questo studio potrebbe essere la base per la progettazione di adeguati studi randomizzati, che dovrebbero prendere in considerazione anche l’andamento del peso corporeo lungo termine come risultato rilevante.
Ringraziamenti
Contributi degli autori: il Professor Castaldo ed il Dott. Cereda hanno avuto pieno accesso a tutti i dati dello studio e preso responsabilità per l’integrità dei dati e la precisione dell’analisi dei dati.
Concetto di studio e progettazione: Castaldo G.
Acquisizione dei dati: Castaldo G, Castaldo L, Galdo G, Monaco L.
Analisi ed interpretazione dei dati: Castaldo G, Galdo G, Cereda.
Redazione del manoscritto: Cereda.
Revisione critica del manoscritto per importante contenuto intellettuale : Castaldo G, Galdo, Monaco, Cereda.
Analisi statistica: Cereda.
Fondi ottenuti: Castaldo G.
Supporto amministrativo, tecnico o materiale: Castaldo G, Cereda, Monaco.
Supervisione dello studio: Castaldo G.
Dichiarazione di trasparenza
Gli autori dichiarano di non avere interessi economici.
Informazione sui fondi
Questo lavoro è stato supportato dal A.O.R.N. “San Giuseppe Moscati ” (Avellino, Italia).
Riferimenti
Abidov M, Ramazanov Z, Seifulla R, Grachev S. 2010. The effects of Xanthigen in the weight management of obese premenopausal women with non-alcoholic fatty liver dis- ease and normal liver fat. Diabetes Obes Metab. 12:72–81.
Asgary S, Naderi GH, Sadeghi M, Kelishadi R, Amiri M. 2004. Antihypertensive effect of Iranian Crataegus curvise- pala Lind.: a randomized, double-blind study. Drugs Exp Clin Res. 30:221–225.
Atkinson RL. 1986. Very low calorie diets: getting sick or remaining healthy on a handful of calories. J Nutr. 116:918–920.
Berryman DE, Glad CA, List EO, Johannsson G. 2013. The GH/IGF-1 axis in obesity: pathophysiology and thera- peutic considerations. Nat Rev Endocrinol. 9:346–356.
Billiet L, Doaty S, Katz JD, Velasquez MT. 2014. Review of hyperuricemia as new marker for metabolic syndrome. ISRN Rheumatol. 2014:852954.
Bistrian BR, Blackburn GL, Flatt JP, Sizer J, Scrimshaw NS, Sherman M. 1976. Nitrogen metabolism and insulin requirements in obese diabetic adults on a protein-sparing modified fast. Diabetes. 25:494–504.
Blackburn GL, Bistrian BR, Flatt JP. 1975. Role of a protein- sparing modified fast in a comprehensive weight reduction program. In: Howard AN, editor. Recent advances in obesity research. London: Newman Publishing, Ltd.
Bravata DM, Sanders L, Huang J, Krumholz HM, Olkin I, Gardner CD. 2003. Efficacy and safety of low-carbohy- drate diets: a systematic review. JAMA. 289:1837–1849.
Cappello G, Franceschelli A, Cappello A, De Luca P. 2012. Weight loss and body composition changes following three sequential cycles of ketogenic enteral nutrition. J Res Med Sci. 17:1114–1118.
Carneiro DM, Freire RC, Hon´orio TC, Zoghaib I, Cardoso FF, Tresvenzol LM, de Paula JR, Sousa AL, Jardim PC, da Cunha LC. 2014. Randomized, double-blind clinical trial to assess the acute diuretic effect of Equisetum arvense (field horsetail) in healthy volunteers. Evid Based Complement Alternat Med. 2014:760683.
Castaldo G, Galdo G, Rotondi Aufiero F, Cereda E. 2015b. Very low-calorie ketogenic diet may allow restoring response to systemic therapy in relapsing plaque psoriasis. Obes Res Clin Pract. [Epub ahead of print]. DOI: 10.1016/ j.orcp.2015.10.008.
Castaldo G, Monaco L, Castaldo L, Sorrentino P. 2015a. A 2-week course of enteral treatment with a very low-calorie protein-based formula for the management of severe obes- ity. Int J Endocrinol. 2015:723735.
Castaldo G, Palmieri V, Galdo G, Castaldo L, Molettieri P, Vitale A, Monaco L. 2016. Aggressive nutritional strategy in morbid obesity in clinical practice: safety, feasibility, and effects on metabolic and haemodynamic risk factors. Obes Res Clin Pract. 10:169–177.
Cereda E, Malavazos AE, Caccialanza R, Rondanelli M, Fatati G, Barichella M. 2011. Weight cycling is associated with body weight excess and abdominal fat accumulation: a cross-sectional study. Clin Nutr. 30:718–723.
Chaston TB, Dixon JB. 2008. Factors associated with percent change in visceral versus subcutaneous abdominal fat dur- ing weight loss: findings from a systematic review. Int J Obes (Lond). 32:619–628.
Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL Jr, Jones DW, Materson BJ, Oparil S, Wright JT Jr, et al. 2003. Seventh report of the joint National Committee on prevention, detection, evaluation, and treatment of high blood pressure. Hypertension. 42:1206–1252.
Cicero AF, De Sando V, Izzo R, Vasta A, Trimarco A, Borghi C. 2012. Effect of a combined nutraceutical con- taining Orthosiphon stamineus effect on blood pressure and metabolic syndrome components in hypertensive dys- lipidaemic patients: a randomized clinical trial. Complement Ther Clin Pract. 18:190–194.
Cohen J. 1992. A power primer. Psychol Bull. 112:155–159.
Dansinger ML, Gleason JA, Griffith JL, Selker HP, SchaeferEJ. 2005. Comparison of the Atkins, Ornish, WeightWatchers, and Zone diets for weight loss and heart diseaserisk reduction: a randomized trial. JAMA. 293:43–53.
Devries MC, Phillips SM. 2015. Supplemental protein in support of muscle mass and health: advantage whey. J Food Sci. 80:A8–A15.
Dombrowski SU, Knittle K, Avenell A, Ara_ujo-Soares V, Sniehotta FF. 2014. Long term maintenance of weight loss with non-surgical interventions in obese adults: systematic review and meta-analyses of randomised controlled trials. BMJ. 348:g2646.
Douyon L, Schteingart DE. 2002. Effect of obesity and starvation on thyroid hormone, growth hormone, and cortisol secretion. Endocrinol Metab Clin North Am. 31:173–189.
Expert panel on detection Evaluation, and treatment of high blood cholesterol in adults. 2001. Executive summary of the third report of the National Cholesterol Education Program (NCEP) expert panel on detection, evaluation and treatment of high blood cholesterol in adults (Adult treatment panel III). JAMA. 285:2486–2497.
Ferenci P, Dragosics B, Dittrich H, Frank H, Benda L, Lochs H, Meryn S, Base W, Schneider B. 1989. Randomized controller trial of silymarin treatment in patients with cirrosi of the liver. J Hepatol. 9:105–113.
Franz MJ, VanWormer JJ, Crain AL, Boucher JL, Histon T, Caplan W, Bowman JD, Pronk NP. 2007. Weight-loss outcomes: a systematic review and meta-analysis of weightloss clinical trials with a minimum 1-year follow-up. J Am Diet Assoc. 107:1755–1767.
Gardner CD, Kiazand A, Alhassan S, Kim S, Stafford RS, Balise RR, Kraemer HC, King AC. 2007. Comparison of the Atkins, Zone, Ornish, and LEARN diets for change in weight and related risk factors among overweight premenopausal women: the A to Z Weight Loss Study: a randomized trial. JAMA. 297:969–977.
Gardner CD, Kim S, Bersamin A, Dopler-Nelson M, Otten J, Oelrich B, Cherin R. 2010. Micronutrient quality of weight-loss diets that focus on macronutrients: results from the A TO Z study. Am J Clin Nutr. 92:304–312.
Gibson AA, Seimon RV, Lee CM, Ayre J, Franklin J, Markovic TP, Caterson ID, Sainsbury A. 2015. Do ketogenic diets really suppress appetite? A systematicreview and meta-analysis. Obes Rev. 16:64–76.
Halmi KA, Stunkard AJ, Mason EE. 1980. Emotional responses to weight reduction by three methods: gastric bypass, jejunoileal bypass, diet. Am J Clin Nutr. 33:446–451.
Hemmingsson E, Johansson K, Eriksson J, Sundstrom J, Neovius M, Marcus C. 2012. Weight loss and dropout during a commercial weight-loss program including a very-low-calorie diet, a low-calorie diet, or restricted normal food: observational cohort study. Am J Clin Nutr. 96:953–961.
Honors MA, Davenport BM, Kinzig KP. 2009. Effects of consuming a high carbohydrate diet after eight weeks of exposure to a ketogenic diet. Nutr Metab (Lond). 6:46.
Hussain TA, Mathew TC, Dashti AA, Asfar S, Al-Zaid N, Dashti HM. 2012. Effect of low-calorie versus low-carbohydrate ketogenic diet in type 2 diabetes. Nutrition. 28:1016–1021.
Istituto nazionale di statistica (ISTAT). Available from: http://www.istat.it/it/(accessed on 20th October 2015).
Jensen MD, Ryan DH, Apovian CM, Ard JD, Comuzzie AG, Donato KA, Hu FB, Hubbard VS, Jakicic JM, Kushner RF, et al. 2014. 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Obesity Society. Circulation. 129:S102–S138.
Kashyap SR, Bhatt DL, Wolski K, Watanabe RM, Abdul-Ghani M, Abood B, Pothier CE, Brethauer S, Nissen S, Gupta M, et al. 2013. Metabolic effects of bariatric surgery in patients with moderate obesity and type 2 diabetes: analysis of a randomized control trial comparing surgery with intensive medical treatment. Diabetes Care. 36:2175–2182.
Kianbakht S, Khalighi-Sigaroodi F, Dabaghian FH. 2013. Improved glycemic control in patients with advanced type 2 diabetes mellitus taking Urtica dioica leaf extract: a randomized double-blind placebo-controlled clinical trial. Clin Lab. 59:1071–1076.
Kosti RI, Panagiotakos DB. 2006. The epidemic of obesity in children and adolescents in the world. Cent Eur J Public Health. 14:151–159.
Leonetti F, Campanile FC, Coccia F, Capoccia D, Alessandroni L, Puzziello A, Coluzzi I, Silecchia G. 2015. Very low-carbohydrate ketogenic diet before bariatric surgery: prospective evaluation of a sequential diet. Obes Surg. 25:64–71.
Lim EL, Hollingsworth KG, Aribisala BS, Chen MJ, Mathers JC, Taylor R. 2011. Reversal of type 2 diabetes: normalisation of beta cell function in association with decreased pancreas and liver triacylglycerol. Diabetologia. 54:2506–2514.
Lirussi F, Beccarello A, Zanette G, De Monte A, Donadon V, Velussi M, Crepaldi G. 2002. Silybin-beta-cyclodextrin in the treatment of patients with diabetes mellitus and alcoholic liver disease. Efficacy study of a new preparation of an antioxidant agent. Diabetes Nutr Metab. 15:222–231.
Liu LT, Zheng GJ, Zhang WG, Guo G, Wu M. 2014. Clinical study on treatment of carotid atherosclerosis with extraction of polygoni cuspidati rhizoma et radix and crataegi fructus: a randomized controlled trial. Zhongguo Zhong Yao Za Zhi. 39:1115–1119.
Maeda H. 2015. Nutraceutical effects of fucoxanthin for obesity and diabetes therapy: a review. J Oleo Sci. 64:125–132.
Malandrucco I, Pasqualetti P, Giordani I, Manfellotto D, De Marco F, Alegiani F, Sidoti AM, Picconi F, Di Flaviani A, Frajese G, et al. 2012. Very-low-calorie diet: a quick therapeutic tool to improve b cell function in morbidly obese patients with type 2 diabetes. Am J Clin Nutr. 95:609–613.
Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. 1985. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 28:412–419.
McLaughlin T, Abbasi F, Cheal K, Chu J, Lamendola C, Reaven G. 2003. Use of metabolic markers to identify overweight individuals who are insulin resistant. Ann Intern Med. 139:802–809.
Monaco L, Monaco M, Di Tommaso L, Stassano P, Castaldo L, Castaldo G. 2014. Aortomesenteric fat thickness with ultrasound predicts metabolic diseases in obese patients. Am J Med Sci. 347:8–13.
Namazi N, Esfanjani AT, Heshmati J, Bahrami A. 2011. The effect of hydro alcoholic Nettle (Urtica dioica) extracts on insulin sensitivity and some inflammatory indicators in patients with type 2 diabetes: a randomized double-blind control trial. Pak J Biol Sci. 14:775–779.
Namazi N, Tarighat A, Bahrami A. 2012. The effect of hydro alcoholic nettle (Urtica dioica) extract on oxidative stress in patients with type 2 diabetes: a randomized doubleblind clinical trial. Pak J Biol Sci. 15:98–102.
Paoli A, Bianco A, Grimaldi KA, Lodi A, Bosco G. 2013b. Long term successful weight loss with a combination biphasic ketogenic Mediterranean diet and Mediterranean diet maintenance protocol. Nutrients. 5:5205–5217.
Paoli A, Rubini A, Volek JS, Grimaldi KA. 2013a. Beyond weight loss: a review of the therapeutic uses of very-owcarbohydrate (ketogenic) diets. Eur J Clin Nutr. 67:789–796.
Prentice AM. 2006. The emerging epidemic of obesity in developing countries. Int J Epidemiol. 35:93–99.
Schugar RC, Crawford PA. 2012. Low-carbohydrate ketogenic diets, glucose homeostasis, and nonalcoholic fatty liver disease. Curr Opin Clin Nutr Metab Care. 15:374–380.
Skidmore PM, Yarnell JW. 2004. The obesity epidemic: prospects for prevention. QJM. 97:817–825.
Stunkard AJ, Rush J. 1974. Dieting and depression reexamined. A critical review of reports of untoward responses during weight reduction for obesity. Ann Intern Med. 81:526–533.
Sukkar SG, Signori A, Borrini C, Barisione G, Ivaldi C, Romeo C, Gradaschi R, Machello N, Nanetti E, Vaccaro Al. 2013. Feasibility of protein-sparing modified fast by tube (ProMoFasT) in obesity treatment: a phase II pilot trial on clinical safety and efficacy (appetite control, body composition, muscular strength, metabolic pattern, pulmonary function test). Med J Nutrition Metab. 6:165–176.
Tsai AG, Wadden TA. 2005. Systematic review: an evaluation of major commercial weight loss programs in the United States. Ann Intern Med. 142:56–66.
Trimarco V, Cimmino CS, Santoro M, Pagnano G, Manzi MV, Piglia A, Giudice CA, De Luca N, Izzo R. 2012. Nutraceuticals for blood pressure control in patients with high-normal or grade 1 hypertension. High Blood Press Cardiovasc Prev. 19:117–122.
Wang YC, McPherson K, Marsh T, Gortmaker SL, Brown M. 2011. Health and economic burden of the projected obesity trends in the USA and the UK. Lancet. 378:815–825.
Wing RR, Blair EH, Bononi P, Marcus MD, Watanabe R, Bergman RN. 1994. Caloric restriction per se is a significant factor in improvements in glycemic control and insulin sensitivity during weight loss in obese NIDDM patients. Diabetes Care. 17:30–36.
World Health Organization (WHO). 1995. Physical status: the use and interpretation of anthropometry. Report of a WHO Expert Committee. World Health Organ Tech Rep Ser. 854:1–452.
Wycherley TP, Moran LJ, Clifton PM, Noakes M, Brinkworth GD. 2012. Effects of energy-restricted highprotein, low-fat compared with standard-protein, low-fat diets: a meta- analysis of randomized controlled trials. Am J Clin Nutr. 96:1281–1298.
L nelle donne e/o l’uso di farmaci ipolipemizzanti; (4) pressione arteriosa ≥130 / 85 mmHg e/o l’uso di agenti ipertensivi; e (5) livello di glicemia a digiuno ≥110 mg/dL.
Variabili di interesse
I cambiamenti (aumento o riduzione a seconda dei casi) nei seguenti parametri di studio sono stati considerati come misure di efficacia del risultato: il peso corporeo, BMI, WC, HC, WHR, AMFT, acido urico, glucosio, insulina, HOMA-IR, peptide-C, emoglobina glicosilata, GH, IGF-1, colesterolo totale, HDL, LDL, trigliceridi, rapporto trigliceridi/HDL, AST, ALT, γ-GT, la pressione sanguigna (SBP e DBP) e la frequenza cardiaca. E’ stata anche registrata giornalmente la frequenza dei seguenti effetti indesiderati, tramite un questionario auto-compilato: astenia, mal di testa, vertigini, svenimenti, ipotensione ortostatica, bruciore di stomaco, nausee, vomito, palpitazioni, crampi muscolari, la fame e la costipazione.
Analisi statistica
A causa della mancanza di dati preliminari su un simile disegno di studio, il dimensionamento del campione è stato calcolato a priori secondo un potere statistico dell’80%, una dimensione dell’effetto di 0,5 (media entità; considerata come clinicamente significativa) (Cohen 1992) ed un errore di tipo I <1,7% (per tenere conto del numero di confronti). Pertanto, sono stati considerati nella popolazione almeno 72 pazienti da analizzare. Statistiche descrittive delle variabili di studio sono state riportate come media e deviazione standard o conteggi e percentuali a seconda dei casi. Il confronto tra i sessi al basale è stato eseguito utilizzando il test esatto di Fisher (variabili categoriche) e t-test di Student (variabili continue). Nell’analisi primaria, i cambiamenti nei parametri di studio durante ogni fase dell’intervento sono stati inizialmente confrontati nel tempo, utilizzando un modello misto per misure ripetute aggiustato per età, sesso, abitudine al fumo, la menopausa e la terapia farmacologica (ove opportuno).
Poi, abbiamo confrontato i cambiamenti tra pazienti con e senza sindrome metabolica (analisi secondaria). Di conseguenza, abbiamo aggiustato le variazioni dei parametri oggetto di studio per i valori basali con un’analisi di covarianza e li abbiamo confrontati con un modello misto per misure ripetute. E’ stata anche studiata l’interazione tra il tempo ed il gruppo (presenza di sindrome metabolica). Tutte le analisi statistiche sono state eseguite utilizzando il software statistico STATA versione 12.0 (Stata Corporation College Station, TX).
Comitato etico
Lo studio è stato eseguito in accordo con i principi della Dichiarazione di Helsinki ed il protocollo è stato approvato dal Comitato Etico della A.O.R.N. ” San Giuseppe Moscati ”. Da ogni paziente è stato ottenuto il consenso informato scritto.
Risultati
In totale sono stati reclutati 73 pazienti (BMI [media ± DS], 33,4 ± 6,3 kg/m² – raggio, 30.2-51.3 kg/m²) di 82 screenati. I principali motivi di esclusione sono stati: storia recente di perdita di peso indotta dalla dieta, n = 5; e il rifiuto del protocollo di studio, n = 3. Tra i 32 pazienti di sesso femminile reclutati, 17 erano in menopausa. Nessuna di loro assumeva contraccettivi orali o effettuava terapia ormonale sostitutiva. Lo stato di fumo attivo è stato segnalato da 16 pazienti. Le caratteristiche basali della popolazione in studio sono presentate nella tabella 1. In particolare, i pazienti di sesso maschile erano caratterizzati da maggiore adiposità addominale, glicemia, creatinina, acido urico, ALT, trigliceridi e rapporto trigliceridi-HDL e più bassi livelli di HDL. Di conseguenza, abbiamo osservato una leggera maggiore prevalenza di sindrome metabolica (58,5% contro il 50%; p-value= 0,487) ed una più frequente tendenza al diabete (24,4% contro 9,4%; p = 0,128). E’ stato anche osservato un più evidente compromissione dell’asse GH-IGF-1.
L’intervento è stato ben tollerato e non si sono verificati eventi avversi gravi. Durante tutto il periodo di trattamento, stipsi e lievi crampi muscolari sono stati gli effetti collaterali più frequentemente riportati (durante OD, 19,2% e 17,8%, rispettivamente). Tuttavia, le loro frequenze si sono significativamente ridotte durante la seconda fase dello studio (11,0% e 2,7%, rispettivamente). Anche la fame è stata segnalata (12,3% e 2,7% durante OD e ipo-MD, rispettivamente). Altri effetti indesiderati meno frequenti (<5%) riportati solo durante la prima fase di intervento, sono stati mal di testa e palpitazioni. Nel complesso, ”nessun effetto collaterale” durante la OD e ipo-MD è stato segnalato da 39 (53,4%) e 63 (86,3%) pazienti, rispettivamente. Come mostrato dai risultati, la perdita di peso corporeo, è stata elevata in entrambe le fasi di intervento: 7,5% e 10% del peso corporeo iniziale, rispettivamente nel 100% e 87,7% dei pazienti. I parametri biochimici hanno anche confermato la sostanziale sicurezza dell’intervento proposto. In particolare, nessuna alterazione (valore al di fuori del normale intervallo di laboratorio) si è verificata nei principali elettroliti sierici, enzimi epatici e parametri di funzionalità renale, anche se un leggero aumento di acido urico è stato osservato a livello di gruppo durante la fase OD (Tabella 2).
La fase di OD è stata associata ad un significativo miglioramento della adiposità viscerale, γ-GT, dei livelli di GH, della pressione sanguigna e della maggior parte dei parametri metabolici, in particolare di quelli relativi al metabolismo glucidico e lipidico; anche se è stato registrato un calo atteso del colesterolo HDL. Allo stesso modo, la OD è stata responsabile di una diminuzione significativa dell’IGF-1. E’ stato osservato un completo ritorno ai livelli basali di IGF-1 al termine della fase ipo-MD, durante la quale è stata anche osservata una riduzione del GH (a valori tuttavia superiori rispetto a quelli di inizio studio). La fase ipo-MD è stata anch’essa responsabile di un persistente effetto positivo sulla adiposità viscerale e sugli enzimi di funzionalità epatica, e di una riduzione consistente dei valori di uricemia. D’altra parte, anche se la progressiva reintroduzione di carboidrati ha portato al ripristino di HDL, questa fase di intervento si è associata ad un significativo rialzo dei parametri di metabolismo sia lipidico che glucidico, mentre la pressione sanguigna è rimasta sostanzialmente stabile.
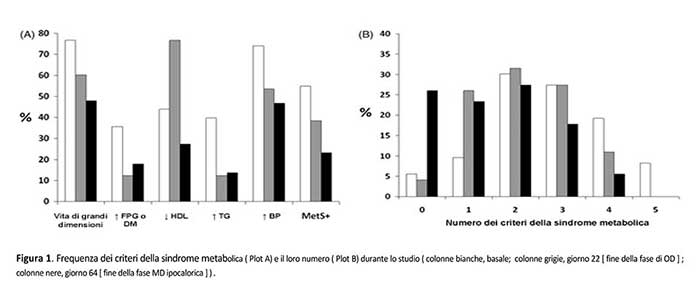
Nel complesso, la prevalenza di sindrome metabolica all’inizio dello studio era del 54,8%. Entrambi gli interventi hanno comportato una progressiva e significativa riduzione della sua frequenza (il rispetto al basale, p=0.017 e p=0.007 per la fase OD e ipo-MD, rispettivamente) e di quella dei relativi criteri diagnostici (Figura 1). In particolare, i cambiamenti più rilevanti sono stati osservati nella fase di OD, anche se una tendenza alla significatività è stata ancora osservata per la fase di ipo-MD. È interessante notare che, in termini di obiettivi secondari di efficacia (Tabella 3), è stato osservato che, indipendentemente da età, sesso, abitudine al fumo, menopausa e terapia farmacologica , la riduzione dell’adiposità viscerale ed il miglioramento delle variabili di controllo glicemico (glucosio, insulina, HOMA-IR, peptide-C, emoglobina glicosilata, trigliceridi, rapporto trigliceridi-HDL) e transaminasi sono stati ancora più marcati nei pazienti con sindrome metabolica. Rispetto a quelli senza, i pazienti con sindrome metabolica hanno mostrato un aumento meno evidente ed una maggiore diminuzione dell’acido urico rispettivamente durante le fasi OD ed ipo-MD. Inoltre, nei pazienti con sindrome metabolica è stata osservata una diminuzione meno evidente ed un più alto incremento di IGF-1 e HDL durante le fasi OD ed ipo-MD, rispettivamente.
Infine, per quanto riguarda il miglioramento del profilo cardiometabolico, si segnala anche che non è stato necessario ripristinare l’uso di agenti ipoglicemizzanti orali e la terapia diuretica. Allo stesso modo, la maggior parte dei pazienti (79,5%, 35 su 44 pazienti) ha richiesto una consistente riduzione del dosaggio (pillole/giorno) di una terapia anti-ipertensiva: basale, 0,86 ± 0,84; fine OD, 0,55 ± 0,66 (p <0.001 rispetto al basale); fine dello studio, 0,45 ± 0,58 (rispetto al basale, p <0.001; rispetto alla fase OD, p=0,016).
Discussione
In questo studio, abbiamo valutato gli effetti della adesione sequenziale a due diete diverse per di contenuto in macronutrienti in pazienti obesi. L’intervento di calo ponderale è consistito in una prima fase di 3 settimane di dieta chetogenica a bassissimo contenuto calorico, ed una successiva fase di 6 settimane di dieta mediterranea ipocalorica, a basso indice glicemico. Nonostante la diversa durata, le due fasi del programma dietetico hanno determinato una perdita di peso simile. Questo potrebbe essere ragionevolmente attribuito al diverso contenuto calorico delle diete (Dansinger et al 2005; Franz et al 2007; Gardner et al 2007; Wycherley et al 2012). Tuttavia, abbiamo osservato anche diversi effetti sulla distribuzione del grasso corporeo e parametri cardiometabolici nella popolazione totale e nei pazienti affetti da sindrome metabolica.
Senza dubbio, un esito positivo di questo studio è stata la compliance all’intervento, con circa il 90% dei pazienti che hanno perso almeno il 7,5% del peso corporeo iniziale e nessun ritiro dallo studio. Il programma dietetico si è dimostrato anche sicuro e ben accettato, e solo un numero limitato di pazienti ha riportato effetti collaterali, in particolare durante la fase di OD. Ciò è in accordo con studi precedenti che affrontano anche la sicurezza e la fattibilità di un digiuno modificato (Blackburn et al 1975; Cappello et al 2012; Sukkar et al 2013; Paoli et al 2013b; Leonetti et al 2015; Castaldo et al 2016, 2015a). Non sono stati segnalati disturbi emotivi, ma studi precedenti di perdita intensiva di peso hanno descritto una loro intensificazione, in particolare della depressione e dell’ansia (Stunkard & Rush 1974;. Halmi et al 1980).
Le diete fortemente ipocaloriche hanno inoltre sollevato ragionevoli preoccupazioni in passato, poiché regimi alimentari con un contenuto calorico inferiore al metabolismo basale potrebbero essere responsabili di malnutrizione, di minerali e micronutrienti a breve termine, e di tutti i nutrienti nel lungo termine (Blackburn et al. 1975; Gardner et al 2010). Inoltre, i regimi chetogenici sono noti essere potenzialmente in grado di causare squilibri elettrolitici ed un aumento dell’acido urico (Blackburn et al 1975; Atkinson 1986). Tuttavia, queste complicanze potrebbero essere evitate usando integratori appropriati e attraverso l’accorciamento della fase di digiuno modificato. Pertanto, un programma di riabilitazione alimentare sequenziale come quello qui proposto consente di ottenere benefici metabolici dei regimi dietetici chetogenici (Blackburn et al 1975; Lim et al 2011; Cappello et al. 2012;. Malandrucco et al 2012; Sukkar et al 2013; Paoli et al 2013b; Leonetti et al 2015; Castaldo et al 2016, 2015A), ma anche di limitare i potenziali effetti negativi associati al passaggio ad un modello alimentare sano ed equilibrato che considera i carboidrati come la principale fonte di calorie. La OD ha comportato una maggiore riduzione di adiposità viscerale rispetto alla ipo-MD, osservazione coerente con le evidenze disponibili sulle diete marcatamente ipocaloriche (Chaston & Dixon 2008). Inoltre, nonostante il significativo miglioramento di tutti i parametri cardiometabolici al termine dello studio, la reintroduzione di una quantità di circa 10 volte superiore di carboidrati di alta qualità, è stata responsabile di un rilevante ri-aumento della glicemia, dell’insulino-resistenza e dei lipidi sierici. Una maggiore assunzione di carboidrati è stata anche responsabile di una riduzione di GH. Tuttavia, abbiamo osservato un ripristino positivo di livelli di HDL, IGF-1 ed un mantenimento di migliori valori di pressione arteriosa. Tendenze analoghe sull’andamento della glicemia, dei lipidi e della pressione arteriosa sono stati recentemente osservati da Paoli et al. (2013b) e Leonetti et al. (2015) quando si applica una dieta chetogenica seguita da una dieta mediterranea o una dieta a basso contenuto calorico, che prevede l’aumento del contenuto in carboidrati. Queste osservazioni sottolineano chiaramente che in pazienti obesi, le complicanze metaboliche associate all’eccesso di peso non solo dipendono dalla distribuzione del grasso viscerale, ma anche dalla composizione della dieta e da come i macronutrienti sono metabolizzati anche in presenza di un bilancio energetico negativo.
Tuttavia, l’intero intervento ha comportato una progressiva riduzione della frequenza della sindrome metabolica e del numero dei suoi criteri in entrambe le fasi. In linea con questo, un risultato interessante sono stati i diversi effetti prodotti dai due regimi dietetici in base alla presenza di sindrome metabolica. Nei pazienti con sindrome metabolica, abbiamo osservato un maggiore miglioramento di tutti i parametri cardiometabolici e dell’ALT ed una riduzione del grasso viscerale durante entrambe le fasi. Questi cambiamenti sono stati ancora più costanti durante la fase OD. Inoltre, durante questa fase, a differenza di tutti gli altri partecipanti, abbiamo assistito ad un meno evidente aumento di acido urico e una più contenuta diminuzione dei livelli di HDL e IGF-1. Anche i risultati sostengono il beneficio metabolico di una dieta chetogenica, poiché l’ acido urico è considerato come una caratteristica aggiuntiva della sindrome metabolica (Billiet et al 2014) ed il trattamento con GH (con conseguente maggiore IGF-1) è stato associato alla riduzione del grasso viscerale (Berryman et al 2013).
I nostri risultati sono coerenti con le recenti osservazioni (Ala et al 1994; Lim et al 2011; Malandrucco et al 2012) che i benefici metabolici a breve termine della perdita di peso in pazienti con insulino-resistenza sono principalmente correlati alla restrizione calorica, piuttosto che ad un miglioramento della sensibilità periferica all’insulina. Di conseguenza, tutte le diete finalizzate al calo ponderale, indipendentemente dalla loro composizione, potrebbero essere efficaci nel ridurre il rischio cardiovascolare sia nel breve che nel lungo periodo (Douyon et al 2002; Dansinger et al 2005; Gardner et al 2007; Wycherley et al 2012; Kashyap et al 2013). Tuttavia, i miglioramenti più consistenti delle complicanze legate all’obesità nei pazienti con sindrome metabolica, suggeriscono che anche l’entità del deficit calorico e come questo è realizzato, può giocare un ruolo attivo. Un breve ciclo iniziale di dieta chetogenica nei pazienti insulino-resistenti esercita un effetto positivo sull’asse GH-IGF-1, inducendo la lipolisi nel tessuto adiposo viscerale, senza compromettere la sensibilità all’insulina (Douyon et al 2002; Schugar & Crawford 2012; Kashyap et al 2013). D’altro canto, studi di chirurgia bariatrica suggeriscono che anche l’ interruzione di assorbimento dei carboidrati svolge un ruolo nel ripristino della funzione delle cellule β-pancreatiche (Kashyap et al. 2013). Di conseguenza, un breve periodo di dieta chetogenica, a bassissimo contenuto calorico, deve essere preferito come strategia di prima linea, almeno nei pazienti insulino-resistenti. Poi, una riabilitazione alimentare ad una dieta equilibrata, potrebbe e dovrebbe essere considerata per evitare un dannoso effetto ”yo-yo” (Cereda et al. 2011). La riabilitazione può inoltre trarre vantaggio dalla transitoria ipofagia post-dieta indotta da chetosi (Honor et al 2009; Gibson et al 2015). Senza dubbio, la necessità di mantenimento a lungo termine della perdita di peso è una priorità e le diete fortemente ipocaloriche sono state valutate come responsabili di una maggiore perdita di peso iniziale e, nonostante un più rapido riguadagno di peso, di un risultato leggermente migliore a lungo termine (Franz et al 2007;. Hemmingsson et al., 2012).
Devono essere riconosciuti alcuni limiti del nostro studio. In primo luogo, non fornisce una risposta alla domanda ancora aperta di come raggiungere un mantenimento della perdita di peso a lungo termine, anche se gli interventi comportamentali fondati su dieta ed attività fisica probabilmente porteranno a un migliore risultato (Dombrowski et al. 2014). In secondo luogo, si potrebbe sostenere che l’uso di rimedi fito-terapici ha influenzato i risultati. Tuttavia, anche se sulla base dei risultati preliminari di alcuni studi clinici randomizzati (Lirussi et al 2002;. Asgary et al 2004;. Abidov et al 2010;. Cicero et al 2012;. Kianbakht et al 2013) un contributo non può essere pienamente escluso, come sopra riportato, i cambiamenti di parametri di efficacia erano coerenti con precedenti risultati sia in termini di direzione che di entità. Tuttavia, i rimedi sono stati usati continuamente durante entrambe le due fasi dello studio. Di conseguenza, un effetto di confondimento sull’impatto indipendente degli interventi dietetici era improbabile ma merita ulteriori indagini.
In terzo luogo, abbiamo condotto uno studio osservazionale prospettico senza gruppo di controllo. Uno studio di fattibilità è un passo importante per la progettazione di nuove strategie terapeutiche, ma è necessario uno studio randomizzato per sostenere i risultati attuali. D’altra parte, in questa prospettiva, il nostro studio rappresenta una preziosa verifica teorica e ha offerto un importante suggerimento su quale strategia di perdita di peso dovrebbe essere considerata in pazienti con sindrome metabolica.
In conclusione, un programma di riabilitazione alimentare costituito da un regime chetogenico fortemente ipocalorico seguito da una dieta mediterranea bilanciata sembra essere un programma fattibile, sicuro ed efficace nel ridurre il rischio cardiovascolare nei pazienti obesi, in particolare in coloro che sono caratterizzati da un’adiposità viscerale e da sindrome metabolica. Questo studio potrebbe essere la base per la progettazione di adeguati studi randomizzati, che dovrebbero prendere in considerazione anche l’andamento del peso corporeo lungo termine come risultato rilevante.
Ringraziamenti
Contributi degli autori: il Prof. Castaldo ed il Dott. Cereda hanno avuto pieno accesso a tutti i dati dello studio e preso responsabilità per l’integrità dei dati e la precisione dell’analisi dei dati.
Concetto di studio e progettazione: Castaldo G.
Acquisizione dei dati: Castaldo G, Castaldo L, Galdo G, Monaco L.
Analisi ed interpretazione dei dati: Castaldo G, Galdo G, Cereda.
Redazione del manoscritto: Cereda.
Revisione critica del manoscritto per importante contenuto intellettuale : Castaldo G, Galdo, Monaco, Cereda.
Analisi statistica: Cereda.
Fondi ottenuti: Castaldo G.
Supporto amministrativo, tecnico o materiale: Castaldo G, Cereda, Monaco.
Supervisione dello studio: Castaldo G.
Dichiarazione di trasparenza
Gli autori dichiarano di non avere interessi economici.
Informazione sui fondi
Questo lavoro è stato supportato dal A.O.R.N. “San Giuseppe Moscati ” (Avellino, Italia).
Riferimenti
Abidov M, Ramazanov Z, Seifulla R, Grachev S. 2010. The effects of Xanthigen in the weight management of obese premenopausal women with non-alcoholic fatty liver dis- ease and normal liver fat. Diabetes Obes Metab. 12:72–81.
Asgary S, Naderi GH, Sadeghi M, Kelishadi R, Amiri M. 2004. Antihypertensive effect of Iranian Crataegus curvise- pala Lind.: a randomized, double-blind study. Drugs Exp Clin Res. 30:221–225.
Atkinson RL. 1986. Very low calorie diets: getting sick or remaining healthy on a handful of calories. J Nutr. 116:918–920.
Berryman DE, Glad CA, List EO, Johannsson G. 2013. The GH/IGF-1 axis in obesity: pathophysiology and thera- peutic considerations. Nat Rev Endocrinol. 9:346–356.
Billiet L, Doaty S, Katz JD, Velasquez MT. 2014. Review of hyperuricemia as new marker for metabolic syndrome. ISRN Rheumatol. 2014:852954.
Bistrian BR, Blackburn GL, Flatt JP, Sizer J, Scrimshaw NS, Sherman M. 1976. Nitrogen metabolism and insulin requirements in obese diabetic adults on a protein-sparing modified fast. Diabetes. 25:494–504.
Blackburn GL, Bistrian BR, Flatt JP. 1975. Role of a protein- sparing modified fast in a comprehensive weight reduction program. In: Howard AN, editor. Recent advances in obesity research. London: Newman Publishing, Ltd.
Bravata DM, Sanders L, Huang J, Krumholz HM, Olkin I, Gardner CD. 2003. Efficacy and safety of low-carbohy- drate diets: a systematic review. JAMA. 289:1837–1849.
Cappello G, Franceschelli A, Cappello A, De Luca P. 2012. Weight loss and body composition changes following three sequential cycles of ketogenic enteral nutrition. J Res Med Sci. 17:1114–1118.
Carneiro DM, Freire RC, Hon´orio TC, Zoghaib I, Cardoso FF, Tresvenzol LM, de Paula JR, Sousa AL, Jardim PC, da Cunha LC. 2014. Randomized, double-blind clinical trial to assess the acute diuretic effect of Equisetum arvense (field horsetail) in healthy volunteers. Evid Based Complement Alternat Med. 2014:760683.
Castaldo G, Galdo G, Rotondi Aufiero F, Cereda E. 2015b. Very low-calorie ketogenic diet may allow restoring response to systemic therapy in relapsing plaque psoriasis. Obes Res Clin Pract. [Epub ahead of print]. DOI: 10.1016/ j.orcp.2015.10.008.
Castaldo G, Monaco L, Castaldo L, Sorrentino P. 2015a. A 2-week course of enteral treatment with a very low-calorie protein-based formula for the management of severe obes- ity. Int J Endocrinol. 2015:723735.
Castaldo G, Palmieri V, Galdo G, Castaldo L, Molettieri P, Vitale A, Monaco L. 2016. Aggressive nutritional strategy in morbid obesity in clinical practice: safety, feasibility, and effects on metabolic and haemodynamic risk factors. Obes Res Clin Pract. 10:169–177.
Cereda E, Malavazos AE, Caccialanza R, Rondanelli M, Fatati G, Barichella M. 2011. Weight cycling is associated with body weight excess and abdominal fat accumulation: a cross-sectional study. Clin Nutr. 30:718–723.
Chaston TB, Dixon JB. 2008. Factors associated with percent change in visceral versus subcutaneous abdominal fat dur- ing weight loss: findings from a systematic review. Int J Obes (Lond). 32:619–628.
Chobanian AV, Bakris GL, Black HR, Cushman WC, Green LA, Izzo JL Jr, Jones DW, Materson BJ, Oparil S, Wright JT Jr, et al. 2003. Seventh report of the joint National Committee on prevention, detection, evaluation, and treatment of high blood pressure. Hypertension. 42:1206–1252.
Cicero AF, De Sando V, Izzo R, Vasta A, Trimarco A, Borghi C. 2012. Effect of a combined nutraceutical con- taining Orthosiphon stamineus effect on blood pressure and metabolic syndrome components in hypertensive dys- lipidaemic patients: a randomized clinical trial. Complement Ther Clin Pract. 18:190–194.
Cohen J. 1992. A power primer. Psychol Bull. 112:155–159.
Dansinger ML, Gleason JA, Griffith JL, Selker HP, SchaeferEJ. 2005. Comparison of the Atkins, Ornish, WeightWatchers, and Zone diets for weight loss and heart diseaserisk reduction: a randomized trial. JAMA. 293:43–53.
Devries MC, Phillips SM. 2015. Supplemental protein in support of muscle mass and health: advantage whey. J Food Sci. 80:A8–A15.
Dombrowski SU, Knittle K, Avenell A, Ara_ujo-Soares V, Sniehotta FF. 2014. Long term maintenance of weight loss with non-surgical interventions in obese adults: systematic review and meta-analyses of randomised controlled trials. BMJ. 348:g2646.
Douyon L, Schteingart DE. 2002. Effect of obesity and starvation on thyroid hormone, growth hormone, and cortisol secretion. Endocrinol Metab Clin North Am. 31:173–189.
Expert panel on detection Evaluation, and treatment of high blood cholesterol in adults. 2001. Executive summary of the third report of the National Cholesterol Education Program (NCEP) expert panel on detection, evaluation and treatment of high blood cholesterol in adults (Adult treatment panel III). JAMA. 285:2486–2497.
Ferenci P, Dragosics B, Dittrich H, Frank H, Benda L, Lochs H, Meryn S, Base W, Schneider B. 1989. Randomized controller trial of silymarin treatment in patients with cirrosi of the liver. J Hepatol. 9:105–113.
Franz MJ, VanWormer JJ, Crain AL, Boucher JL, Histon T, Caplan W, Bowman JD, Pronk NP. 2007. Weight-loss outcomes: a systematic review and meta-analysis of weightloss clinical trials with a minimum 1-year follow-up. J Am Diet Assoc. 107:1755–1767.
Gardner CD, Kiazand A, Alhassan S, Kim S, Stafford RS, Balise RR, Kraemer HC, King AC. 2007. Comparison of the Atkins, Zone, Ornish, and LEARN diets for change in weight and related risk factors among overweight premenopausal women: the A to Z Weight Loss Study: a randomized trial. JAMA. 297:969–977.
Gardner CD, Kim S, Bersamin A, Dopler-Nelson M, Otten J, Oelrich B, Cherin R. 2010. Micronutrient quality of weight-loss diets that focus on macronutrients: results from the A TO Z study. Am J Clin Nutr. 92:304–312.
Gibson AA, Seimon RV, Lee CM, Ayre J, Franklin J, Markovic TP, Caterson ID, Sainsbury A. 2015. Do ketogenic diets really suppress appetite? A systematicreview and meta-analysis. Obes Rev. 16:64–76.
Halmi KA, Stunkard AJ, Mason EE. 1980. Emotional responses to weight reduction by three methods: gastric bypass, jejunoileal bypass, diet. Am J Clin Nutr. 33:446–451.
Hemmingsson E, Johansson K, Eriksson J, Sundstrom J, Neovius M, Marcus C. 2012. Weight loss and dropout during a commercial weight-loss program including a very-low-calorie diet, a low-calorie diet, or restricted normal food: observational cohort study. Am J Clin Nutr. 96:953–961.
Honors MA, Davenport BM, Kinzig KP. 2009. Effects of consuming a high carbohydrate diet after eight weeks of exposure to a ketogenic diet. Nutr Metab (Lond). 6:46.
Hussain TA, Mathew TC, Dashti AA, Asfar S, Al-Zaid N, Dashti HM. 2012. Effect of low-calorie versus low-carbohydrate ketogenic diet in type 2 diabetes. Nutrition. 28:1016–1021.
Istituto nazionale di statistica (ISTAT). Available from: http://www.istat.it/it/(accessed on 20th October 2015).
Jensen MD, Ryan DH, Apovian CM, Ard JD, Comuzzie AG, Donato KA, Hu FB, Hubbard VS, Jakicic JM, Kushner RF, et al. 2014. 2013 AHA/ACC/TOS guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the Obesity Society. Circulation. 129:S102–S138.
Kashyap SR, Bhatt DL, Wolski K, Watanabe RM, Abdul-Ghani M, Abood B, Pothier CE, Brethauer S, Nissen S, Gupta M, et al. 2013. Metabolic effects of bariatric surgery in patients with moderate obesity and type 2 diabetes: analysis of a randomized control trial comparing surgery with intensive medical treatment. Diabetes Care. 36:2175–2182.
Kianbakht S, Khalighi-Sigaroodi F, Dabaghian FH. 2013. Improved glycemic control in patients with advanced type 2 diabetes mellitus taking Urtica dioica leaf extract: a randomized double-blind placebo-controlled clinical trial. Clin Lab. 59:1071–1076.
Kosti RI, Panagiotakos DB. 2006. The epidemic of obesity in children and adolescents in the world. Cent Eur J Public Health. 14:151–159.
Leonetti F, Campanile FC, Coccia F, Capoccia D, Alessandroni L, Puzziello A, Coluzzi I, Silecchia G. 2015. Very low-carbohydrate ketogenic diet before bariatric surgery: prospective evaluation of a sequential diet. Obes Surg. 25:64–71.
Lim EL, Hollingsworth KG, Aribisala BS, Chen MJ, Mathers JC, Taylor R. 2011. Reversal of type 2 diabetes: normalisation of beta cell function in association with decreased pancreas and liver triacylglycerol. Diabetologia. 54:2506–2514.
Lirussi F, Beccarello A, Zanette G, De Monte A, Donadon V, Velussi M, Crepaldi G. 2002. Silybin-beta-cyclodextrin in the treatment of patients with diabetes mellitus and alcoholic liver disease. Efficacy study of a new preparation of an antioxidant agent. Diabetes Nutr Metab. 15:222–231.
Liu LT, Zheng GJ, Zhang WG, Guo G, Wu M. 2014. Clinical study on treatment of carotid atherosclerosis with extraction of polygoni cuspidati rhizoma et radix and crataegi fructus: a randomized controlled trial. Zhongguo Zhong Yao Za Zhi. 39:1115–1119.
Maeda H. 2015. Nutraceutical effects of fucoxanthin for obesity and diabetes therapy: a review. J Oleo Sci. 64:125–132.
Malandrucco I, Pasqualetti P, Giordani I, Manfellotto D, De Marco F, Alegiani F, Sidoti AM, Picconi F, Di Flaviani A, Frajese G, et al. 2012. Very-low-calorie diet: a quick therapeutic tool to improve b cell function in morbidly obese patients with type 2 diabetes. Am J Clin Nutr. 95:609–613.
Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. 1985. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 28:412–419.
McLaughlin T, Abbasi F, Cheal K, Chu J, Lamendola C, Reaven G. 2003. Use of metabolic markers to identify overweight individuals who are insulin resistant. Ann Intern Med. 139:802–809.
Monaco L, Monaco M, Di Tommaso L, Stassano P, Castaldo L, Castaldo G. 2014. Aortomesenteric fat thickness with ultrasound predicts metabolic diseases in obese patients. Am J Med Sci. 347:8–13.
Namazi N, Esfanjani AT, Heshmati J, Bahrami A. 2011. The effect of hydro alcoholic Nettle (Urtica dioica) extracts on insulin sensitivity and some inflammatory indicators in patients with type 2 diabetes: a randomized double-blind control trial. Pak J Biol Sci. 14:775–779.
Namazi N, Tarighat A, Bahrami A. 2012. The effect of hydro alcoholic nettle (Urtica dioica) extract on oxidative stress in patients with type 2 diabetes: a randomized doubleblind clinical trial. Pak J Biol Sci. 15:98–102.
Paoli A, Bianco A, Grimaldi KA, Lodi A, Bosco G. 2013b. Long term successful weight loss with a combination biphasic ketogenic Mediterranean diet and Mediterranean diet maintenance protocol. Nutrients. 5:5205–5217.
Paoli A, Rubini A, Volek JS, Grimaldi KA. 2013a. Beyond weight loss: a review of the therapeutic uses of very-owcarbohydrate (ketogenic) diets. Eur J Clin Nutr. 67:789–796.
Prentice AM. 2006. The emerging epidemic of obesity in developing countries. Int J Epidemiol. 35:93–99.
Schugar RC, Crawford PA. 2012. Low-carbohydrate ketogenic diets, glucose homeostasis, and nonalcoholic fatty liver disease. Curr Opin Clin Nutr Metab Care. 15:374–380.
Skidmore PM, Yarnell JW. 2004. The obesity epidemic: prospects for prevention. QJM. 97:817–825.
Stunkard AJ, Rush J. 1974. Dieting and depression reexamined. A critical review of reports of untoward responses during weight reduction for obesity. Ann Intern Med. 81:526–533.
Sukkar SG, Signori A, Borrini C, Barisione G, Ivaldi C, Romeo C, Gradaschi R, Machello N, Nanetti E, Vaccaro Al. 2013. Feasibility of protein-sparing modified fast by tube (ProMoFasT) in obesity treatment: a phase II pilot trial on clinical safety and efficacy (appetite control, body composition, muscular strength, metabolic pattern, pulmonary function test). Med J Nutrition Metab. 6:165–176.
Tsai AG, Wadden TA. 2005. Systematic review: an evaluation of major commercial weight loss programs in the United States. Ann Intern Med. 142:56–66.
Trimarco V, Cimmino CS, Santoro M, Pagnano G, Manzi MV, Piglia A, Giudice CA, De Luca N, Izzo R. 2012. Nutraceuticals for blood pressure control in patients with high-normal or grade 1 hypertension. High Blood Press Cardiovasc Prev. 19:117–122.
Wang YC, McPherson K, Marsh T, Gortmaker SL, Brown M. 2011. Health and economic burden of the projected obesity trends in the USA and the UK. Lancet. 378:815–825.
Wing RR, Blair EH, Bononi P, Marcus MD, Watanabe R, Bergman RN. 1994. Caloric restriction per se is a significant factor in improvements in glycemic control and insulin sensitivity during weight loss in obese NIDDM patients. Diabetes Care. 17:30–36.
World Health Organization (WHO). 1995. Physical status: the use and interpretation of anthropometry. Report of a WHO Expert Committee. World Health Organ Tech Rep Ser. 854:1–452.
Wycherley TP, Moran LJ, Clifton PM, Noakes M, Brinkworth GD. 2012. Effects of energy-restricted highprotein, low-fat compared with standard-protein, low-fat diets: a meta- analysis of randomized controlled trials. Am J Clin Nutr. 96:1281–1298.

